C-1-008
原文
Lee, J. Y., Finlayson, C., Olson-Kennedy, J., Garofalo, R., Chan, Y.-M., Glidden, D. V., & Rosenthal, S. M. (2020).
Low Bone Mineral Density in Early Pubertal Transgender/Gender Diverse Youth: Findings From the Trans Youth Care Study.
Journal of the Endocrine Society, 4(9), bvaa065.
抄録
背景
トランスジェンダーの若者は、骨量の増加にとって重要な時期である第二次性徴を抑制するためにGnRHアゴニスト(GnRHa)を開始することがある。第二次性徴期後期のトランスジェンダー少女では、ジェンダー肯定治療前に骨塩密度(BMD)が低いことが報告されているが、第二次性徴期のトランスジェンダー少年のBMDについてはほとんど知られていない。
目的
第二次性徴期早期のトランスジェンダーの若者におけるBMDについて記述すること。
研究計画
将来的、観察的、長期的なトランスユースケア研究コホートの横断的解析。
設定
米国のアカデミックな4つの小児ジェンダーセンター。
参加者
GnRHaを開始した第二次性徴早期のトランスジェンダーの若者。
主要評価項目
面的および体積的BMD Zスコア。
結果
生得的男性(DMAB)は男性基準値と比較してBMD Zスコアが平均以下であり、生得的女性(DFAB)は股関節部位を除き女性基準値と比較してBMD Zスコアが平均以下であった。少なくとも1つのBMD Zスコアが-2未満であったのは、DMABの30%、DFABの13%であった。低BMDの若年者は、正常なBMDの若年者よりも、高年齢児童向け運動量アンケートの得点が低く、2.32±0.71対2.76±0.61であった(P = 0.01)。ビタミンDの顕著な欠乏はみられなかったが、食事からのカルシウム摂取量はすべての若年者において最適ではなかった。
結論
第二次性徴期早期のトランスジェンダーの若者において、BMDは生得的性別の基準値よりも低かった。この低いBMDは、部分的には、介入の対象となりうるカルシウム摂取量の最適化と身体活動の低下によって説明されるかもしれない。われわれの結果は、第二次性徴期前の多様なジェンダーの若年者におけるBMDの評価と、第二次成長期のジェンダー肯定医療中のBMDの継続的モニタリングの潜在的必要性を示唆している。
SEGMによる解説
これは、GnRHアゴニスト投与開始前または開始直後の63人の第二次性徴早期のトランスジェンダー少年少女における骨密度の多施設横断解析である。
平均BMD Zスコアは、一般集団の性別と比較して、研究対象者において低いことが判明した。 Zスコアが-2未満であったのは男性の30%、女性の15%であった。
身体活動(PAQ-C)の低下と骨密度の低下との間に相関がみられた。 カルシウム摂取量はコホート間で低かったが、これは骨密度の差とは相関しなかった。25-ヒドロキシビタミンDに差はみられなかった。
著者らは、ホルモン療法前の骨の健康状態の悪さが、この集団における骨密度の悪さの少なくとも部分的な原因であると結論づけている。この知見の重要性を十分に解釈するためには、すべての比較において対照集団との直接比較が必要である。
弱点
観察的GnRHアゴニスト研究コホートの被験者の3分の1がこの解析から除外された。対照群が含まれていない。
論文
アメリカのティーンエイジャーの0.7%~2.7%がトランスジェンダーまたはジェンダー・ノンコンフォーミングであると推定されており [1-3] 、アメリカでは10年以上前からトランスジェンダーや多様なジェンダーの(TGD)の若年者に対するジェンダー肯定的ホルモン療法(GAH)が行われている [4] 。それ以来、小児GAHへのアクセスは急速に拡大し、多くの著名な学術機関が学際的なクリニックを設立し、しばしばコミュニティセンターと提携している [5] 。ジェンダー違和(性別違和:gender dysphoria)の診断基準を満たす若年者に対しては [6] 、現在のガイドラインでは、肯定されたジェンダーと矛盾する身体的変化を防ぎ、ジェンダー探求のための時間を確保するために、GnRHアゴニスト(GnRHa)を用いてタナーステージ2の早い段階で思春期を休止することが推奨されている [7, 8]。しかしながら、このような若年者における早期の二次性徴抑制が骨格の健康や骨塩密度(BMD)に及ぼす長期的な影響についてはほとんど知られていない。
オランダのデータでは、二重エネルギーX線吸収測定法(DXA)により測定された治療前のBMD Zスコアは、GnRHa投与前の思春期後期のトランスジェンダー少女において有意に低く、エストラジオールによる治療では正常化しなかったことが示されている [9, 10]。成人の研究でも同様に、GAHの前後でトランスジェンダー女性のBMD Zスコアが低いことが示されている [11-13] 。英国の研究では、思春期後期のトランスジェンダー少年は、治療前のDXAによる背骨と股関節のBMD Zスコアが低いことが示された [14] 。対照的に、思春期後期または思春期以降のトランスジェンダー少年(年齢中央値16.5歳)に焦点を当てた別のオランダの研究では、背骨と股関節のDXAによる治療前のBMD Zスコアの平均値は正常であった [15] 。しかしながら、思春期早期のトランスジェンダー若年者のBMDや、この集団における骨格の健康に影響を与える因子(食事からのカルシウム摂取、ビタミンDの状態、ウエイトトレーニング運動など)については、ほとんど知られていない。先に述べた思春期後期の若年者および成人における研究で観察された低いBMD Zスコアに基づき、BMDにおけるこのような格差がいつ現れるのかを明らかにするためには、思春期早期のトランスジェンダー若年者のさらなる調査が必要である。
思春期早期に二次性徴抑制を開始した63名のアメリカ人TGD若年者の多施設コホートから得られた治療前のBMDデータを提示する。また、介入の潜在的ターゲットを同定するために、骨の健康に関するいくつかの項目を検討した。
1. 研究対象と方法
TGDの若年者とは、ジェンダーアイデンティティが生得的性別と反対、ノンバイナリー、またはジェンダーフルイドである 若年者[16] と定義され、4つの研究施設(ロサンゼルス小児病院、ルーリー小児病院、ボストン小児病院、カリフォルニア大学サンフランシスコ校ベニオフ小児病院)から前向きに登録され、前述の観察的なトランスユースケア研究に参加した [17] 。このコホートにおける適格候補者は、タナー病期2-3期(乳房または精巣の診察に基づく)で、GnRHaによる第二次性徴抑制治療を開始している者であった。主要アウトカムは、DXAおよび定量的コンピュータ断層撮影法(QCT)によりそれぞれ計測された面的(areal)BMD(aBMD)および体積的(volumetric)BMD(vBMD)のZスコアであった。BMDは第二次性徴抑制薬の投与開始前または投与開始後2ヵ月以内に計測した。第二次性徴抑制薬コホートの95人の参加者のうち、13人はDXAまたはQCTが実施されなかったため除外され、13人は思春期のタナーステージ4であったため除外され、6人はDXAが第二次性徴抑制開始後2ヵ月以上経過してから評価されたため除外された。これらの32人が除外された後、合計63人がデータ解析の対象となった。組み入れられた参加者の90%以上(57/63人)は、GnRHa投与開始前にBMDを計測していた。
この研究は観察研究であるため、BMDの計測に使用された方法および機械は研究施設によって異なっていた。ロサンゼルス小児病院では、皮質および海綿骨のvBMDが、それぞれ大腿骨中節およびL1-L3椎体においてQCTにより計測された [18] 。ルーリー小児病院では、GE/Lunar社製のiDXA装置を使用し、全身頭部(TBLH)および腰椎のスキャンを行った。ボストン小児病院とカリフォルニア大学サンフランシスコ校ベニオフ小児病院は、ホロジック社製Discovery A型DXA装置を使用し、TBLH、腰椎、全股関節(TH)および大腿骨頚部のスキャンを行った。保険適用の関係から、参加者の17%(11/63人)はDXAスキャンを外部の施設で受けた。治療前のBMD Zスコアは、生得性別に従って分析し、部位間のデータ比較を可能にするために、Hologic DXAスキャンについて身長Zスコアによる調整を計算した [19] 。画像モダリティと評価部位に大きな違いがあるため、aBMDとvBMDのZスコアは別々に解析した。Lunar BMD Zスコアと身長調整Hologic BMD Zスコアを別々に解析したところ同様の結果が得られたため [20] 、aBMD Zスコアの結果をプールした。血清25-ヒドロキシビタミンDは標準的な臨床検査法で測定し、食事性カルシウム摂取量は1週間食品目録質問票で評価し、身体活動量は様々な活動に対する身体活動量をリッカート尺度(1=最も低い活動量、5=最も高い活動量)で評価するPAQ-C(Physical Activity Questionnaire for Older Children高年齢児童向け運動量アンケート)[21、22]で評価した。
すべてのデータ解析はStata, v16(College Station, TX)[23]を用いて行い、生得性別、または少なくとも1つのBMD Zスコア<-2によって定義される低BMDの有無によって層別化した。群間の比較はStudentのt検定を用いて行った。正規分布残差の仮定を検証し、線形性からの逸脱を評価した後、線形回帰モデルを用いて、選択した予測因子がBMD Zスコアの統計的に有意な予測因子であるかどうかを決定した。すべての統計解析において有意水準α=0.05を設定した。参加者の特性は、ANOVA(analysis of variance分散分析)を用いて4施設間で比較されたが、施設による統計的に有意な差は示されなかった[20]。
2. 結果
A. 対象患者のデモグラフィック(年齢、性別、階層等の分布)
コホートの人口統計によると、生得性別は基本的に均衡がとれており、人種は白人が大多数(56%)、世帯総所得は10万ドル以上が大多数(75%)、保護者・親の大多数が学部卒または大学院卒・専門職学位取得者(68%)であった(表1)。参加者の大多数がバイナリーを自認し(92%)、参加者の64%が思春期のタナーステージ2であった。生得的女性(DFAB)と生得的男性(DMAB)の間の第二次性徴抑制薬開始時の年齢の差は、11.0±1.4歳対12.1±1.3歳(P = 0.002)と生得的性別の予想される第二次性徴開始時期を反映していた。
表1:デモグラフィック(n=63患者)
B. BMDの主要評価項目
aBMDまたはvBMDのZスコアが-2未満と定義される低値は、DMABの30%(10/33、95%confidence interval信頼区間[CI]、15.6-48.7)およびDFABの13%(4/30、95%CI、3.8-30.7)で観察され、正規分布で予想される2.3%よりも有意に高かった(図1)。低BMDの参加者の部分集合を検討すると、25-ヒドロキシビタミンD値は28.7±10.8ng/mL、1日のカルシウム摂取量は520±383mg/d、PAQ-Cスコアは2.32±0.71、BMI Zスコアは0.08±1.57であった。この低BMD群における第二次性徴抑制薬開始時の平均年齢は12.0±1.7歳で、平均タナー期は2.43±0.51であった(表2)。生得性別による層別化がさらに行われた;これらのデータは別途報告されている[20]。この低BMD群では、血清25-ヒドロキシビタミンDが20ng/mL未満であった参加者は1名のみであり、1日のカルシウム摂取量が1300mg/日以上であった参加者は1名のみであった。正常BMD群と比較して、低BMD群ではPAQ-C得点が統計学的に有意に低く、2.32±0.71対2.76±0.61であった(P = 0.01)。
表2:低BMDと正常BMDの比較による骨の健康の決定因子
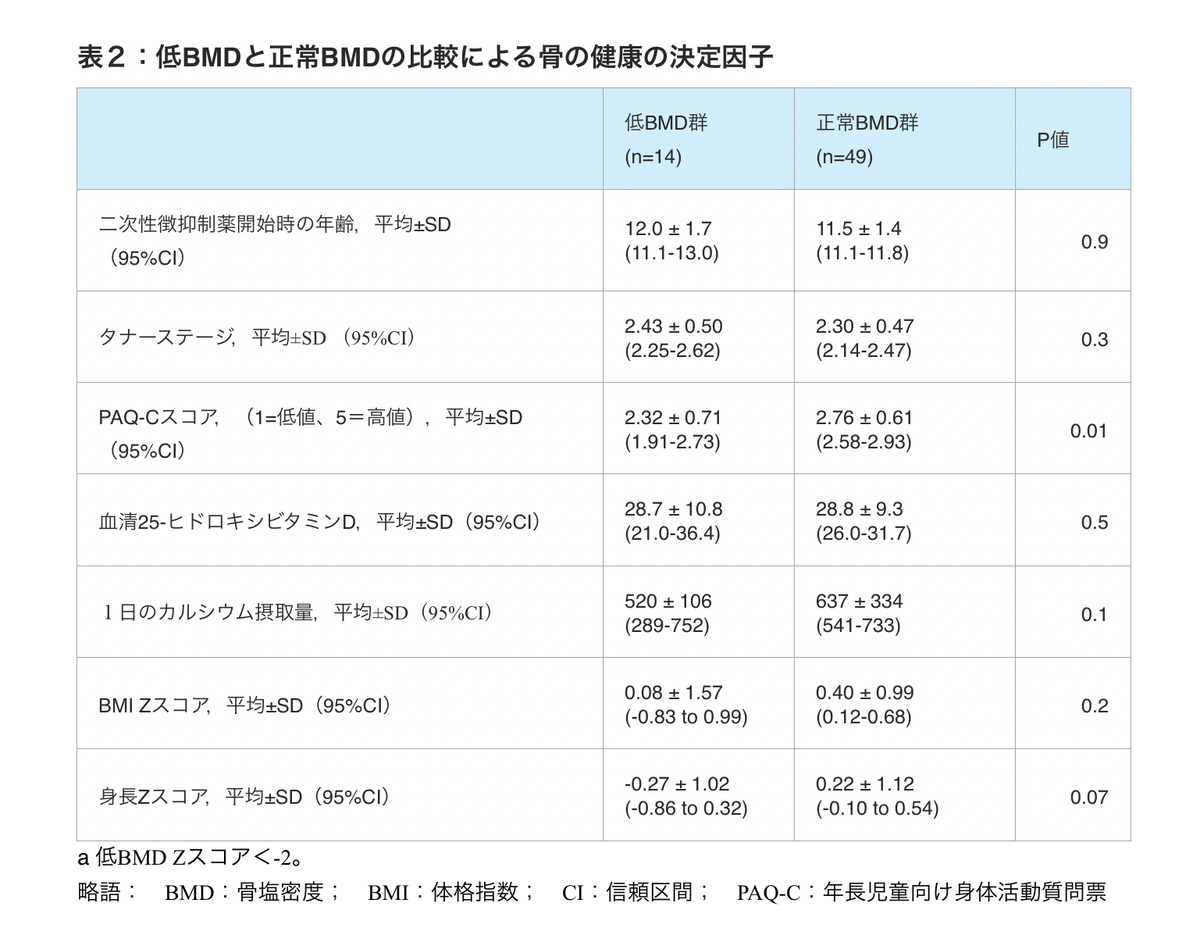
図1:生得的性別の正常BMD値と低BMD値の対比

図1:低BMDと正常BMDの割合。少なくとも1つのBMD Zスコアが-2未満と定義される低BMDの割合が、トランスジェンダー/多様なジェンダーの若年者のコホートにおいて著しく高いことを示す棒グラフ。低BMDのエラーバーは95%信頼区間を示す。データは生得的性別で層別化されており、生得的女性よりも生得的男性の方が治療前の低BMDの頻度が高いことを示している(0.30±0.47 vs 0.13±0.35、P = 0.0545)。水平基準線は、正規分布においてBMD Zスコア<-2となることが予想される2.3%のラインを示す。BMDは骨塩密度,DFABは生得的女性,DMABは生得的男性。
aBMDおよびvBMDのZスコア(図2および3)は、平均BMD Zスコアが一貫してDFABよりDMABの方が低く、主に皮質骨の測定値を反映する股関節部位では統計的に有意な差がみられた。
図2:面的骨塩密度Zスコア 生得的性別による四種データ比較

図2:面的骨塩密度Zスコア。生得的男性(左)と生得的女性(右)について、4部位(FN:大腿骨頸部、LS:腰椎、TBLH:全身(頭部除く)、TH:股関節全体)の面的BMD Zスコア(生得的性別の参照基準により決定)の箱ひげ図を示す。ボックスは四分位範囲(IQR、25~75パーセンタイル)、白棒は中央値、ひげは最小値(四分位1~1.5 * IQR)と最大値(四分位3 + 1.5 * IQR)、ポイントは異常値を示す。Hologic社製DXA装置(31/47台)のBMD Zスコアは、身長Zスコアを調整し、Lunar社製DXA装置(16/47台)のBMD Zスコアと組み合わせた。BMD、骨塩密度。BMDは骨塩量密度、FNは大腿骨頸部、LSは腰椎、TBLHは全身から頭部を除いたもの、THは全股関節。
図3:体積骨塩密度Zスコア 生得的性別による比較
 図3:体積骨塩密度Zスコア。2つの部位(海綿骨密度:L1-L3椎体、皮質骨密度:大腿骨中部)における体積BMD Zスコア(生得的性別の参照基準により決定)の箱ひげ図:生得的男性(左)と生得的女性(右)について、2つの部位(海綿骨密度:L1-L3椎体、皮質骨密度:大腿骨中部)の体積BMD Zスコア(生得的性別の基準で決定)を示す。枠は四分位範囲(IQR、25~75パーセンタイル)、白棒は中央値、ひげは最小値(四分位1~1.5 * IQR)と最大値(四分位3 + 1.5 * IQR)、点は外れ値を示す。BMDは骨塩密度。
図3:体積骨塩密度Zスコア。2つの部位(海綿骨密度:L1-L3椎体、皮質骨密度:大腿骨中部)における体積BMD Zスコア(生得的性別の参照基準により決定)の箱ひげ図:生得的男性(左)と生得的女性(右)について、2つの部位(海綿骨密度:L1-L3椎体、皮質骨密度:大腿骨中部)の体積BMD Zスコア(生得的性別の基準で決定)を示す。枠は四分位範囲(IQR、25~75パーセンタイル)、白棒は中央値、ひげは最小値(四分位1~1.5 * IQR)と最大値(四分位3 + 1.5 * IQR)、点は外れ値を示す。BMDは骨塩密度。
C. 骨の健康の決定因子
生得的性別による骨の健康の決定因子を検討した結果、15%(DMAB5名、DFAB3名、血清25-ヒドロキシビタミンDを測定したTGD若年者の53分の8)がビタミンD不足(20ng/mL未満)であった。特筆すべきことに、すべてのTGD若年者の1日あたりのカルシウム摂取量は平均613±345mgと最適ではなく、推奨されている1日あたり1300mgをはるかに下回っていた [24, 25]。カルシウム摂取に関するこれらの推奨食事摂取量は理想を追及し過ぎとも考えられるが、2003年から2006年のNational Health and Nutrition Examination Studyのデータに基づく先行文献では、9~13歳の小児は1日あたり約1000mgのカルシウムを摂取していたと報告されている [26] 。血清25-ヒドロキシビタミンD、1日のカルシウム摂取量、BMI Zスコアにおいて、生得的性別による統計学的有意差は認められなかった(表3)。
表3. 骨の健康の決定要因(生得的性別による比較)
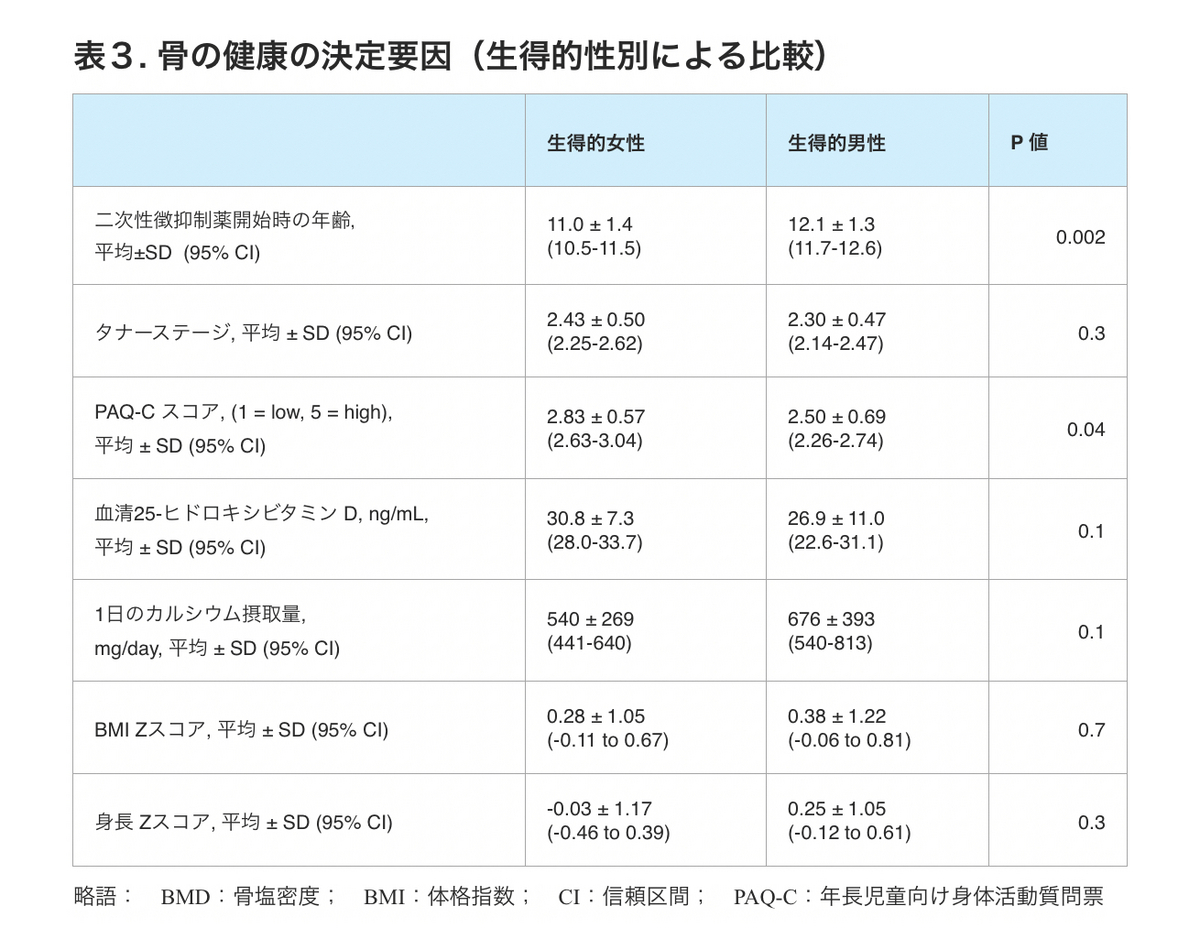
PAQ-Cの身体活動スコアは、DFABとDMABの間で統計的に有意な差があり、DFABはDMABより高い活動スコアを報告し、2.83±0.57対2.50±0.69(P = 0.04)であった(表3)。参考までに、1997年に行われたPAQ-Cの最初の検証研究では、ジェンダーアイデンティティを問わない9~15歳の男児125名と女児90名の得点が調査され、PAQ-Cの身体活動得点の平均は男児3.44±0.68点、女児2.96±0.69点であった[21]。643人の小学5年生を対象とした、より最近のカナダの学校ベースの評価でも、PAQ-C身体活動スコアの平均は男児で3.36±0.72、女児で3.21±0.72であった[27]。TGD者の有病率に関する集団研究を考慮すると、前述の研究 [21, 27]は主にシスジェンダーである若年者について述べていると考えられる。
D. BMD Zスコアの有意な予測因子
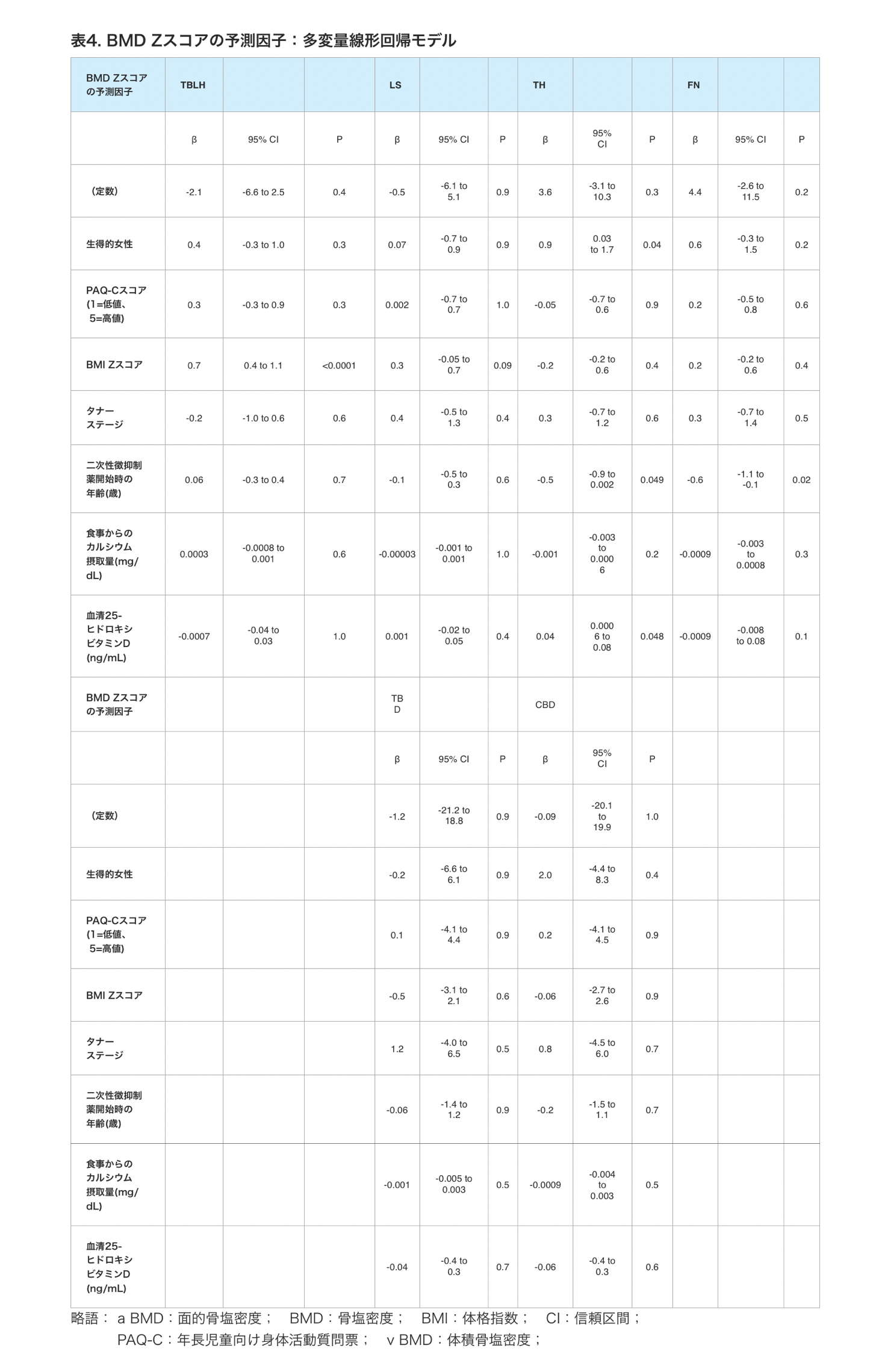
以前に記載されたように、BMDおよび骨の健康の決定因子の概念的枠組みを用いて [28] 、BMD Zスコアに寄与する有意な変数を評価するために多変量線形回帰分析を実施した。以下の予測因子を線形回帰モデルに含めた:生得的性別、PAQ-Cスコア、BMI Zスコア、タナー期、第二次性徴抑制薬開始時の年齢、食事からのカルシウム摂取量、および血清25-ヒドロキシビタミンD(表4)。BMIのZスコアはTBLH部位のBMDのZスコアに正の寄与を示した(P < 0.0001)。生得的女性の性(P = 0.04)と血清25-ヒドロキシビタミンD(P = 0.048)は正の予測因子であり、第二次性徴抑制薬開始時の年齢(P = 0.049)はTH BMD Zスコアの負の予測因子であった。第二次性徴抑制薬開始時年齢(P = 0.02)は大腿骨頸部BMD Zスコアの負の予測因子であった。海綿体および皮質のvBMD Zスコアについては、統計的に有意な予測因子はなかった。
まとめると、生得的性別が女性であり、血清25-ヒドロキシビタミンDが高いことは、TH BMD Zスコアが高いことと関連し、第二次性徴抑制薬開始年齢が遅いことは、DXA股関節部位のBMD Zスコアが低いことと関連した。TBLH部位では、BMI Zスコアが高いほどBMD Zスコアも高かった。
表4:BMD Zスコアの予測因子:多変量線形回帰モデル
3. 考察
我々は、GnRHa療法を開始する前の思春期早期のTGD若年者において、低BMD(Zスコア<-2)の有病率が高く、DFABよりもDMABの方が高いことを同定した。この知見は、思春期後期のトランスジェンダー若年者を対象とした先行研究 [9] を追認するものであり、低BMDは思春期前期までにすでに存在し、したがってこの格差は思春期前に生じる可能性があることを実証するものである。したがって、思春期前のTGD若年者における低BMDの早期発見により、この治療前のBMDの不一致を緩和するための潜在的介入の時期を拡大することができ、ひいてはGnRHa[9、10、14、15]によりBMD Zスコアがさらに低下すると予想される。私たちの線形回帰の結果は、この概念を支持するものであった。というのも、第二次性徴抑制薬開始時の年齢が、股関節部位のBMD Zスコアと負の相関を示したためであり、このことは、低BMDの原因となる根本的な因子が、負の影響を及ぼすまでに時間がかかる可能性があることを示唆している。この否定的な関連は、DMABとDFABの思春期開始時期の違いによって説明することもできる。加えて、適格性が早期思春期の状態に基づいていたため、研究コホートの高年齢者は通常より遅く思春期を迎えており、そのため、より典型的な年齢で思春期を迎え、それ以降異性化ホルモンの有意な投与があった若年者と比較して、BMDが低くなることが予想される。BMDのZスコアに対する第二次性徴抑制薬開始時のタナー期の寄与は、どの解剖学的部位においても統計学的に有意ではなかったが、回帰モデルにおけるβ係数のほとんどが正の値であったことから、思春期ホルモンが骨塩量に及ぼすプラスの影響を反映して、二次性徴抑制薬開始時のタナー期が遅ければ遅いほど、BMDのZスコアにプラスの影響を及ぼすことが示唆された。
さらに、DMAB群とDFAB群では、股関節部位のBMD Zスコアに統計学的に有意な差があった。国際臨床骨密度測定学会(International Society for Clinical Densitometry)は、股関節は小児のDXA測定には好ましくない部位であると指摘しているが [29] 、股関節は主に皮質骨であるのに対し、腰椎は主に海綿骨である。臀部は脊椎よりも早く無灰化するため [30] 、他の部位で明らかになる前に臀部で違いを観察できる可能性がある。また、股関節は体重を支える部位でもあり、DMABの若年者でBMD Zスコアが低いことは、DMABの若年者でPAQ-Cスコアが低いという所見を考えれば納得がいく。最後に、国際臨床デンシトメトリー学会(International Society for Clinical Densitometry)は、成人期までDXA測定を継続することが有益である下肢の体重負荷が減少している小児の評価に、大腿骨近位部のDXA測定が有用である可能性を示唆している[29]。
骨格の健康の決定因子に関して、PAQ-Cスコアは全体的に低く、DFAB群よりDMAB群で有意に低かった。しかし、回帰モデルはPAQ-C得点がこれらの差を完全に説明できないことを示し、他の要因もこの差に寄与している可能性を示唆した。身体活動の低下が低BMD Zスコアの一因であるという仮説をさらに補強しているのは、正常BMD群と比較して低BMD群のPAQ-Cスコアが統計的に有意に低いことである。従来の性別(ジェンダーアイデンティティ未確認)に従った先行研究では、男児は女児よりもPAQ-C得点が高いことが報告されている[21、22];したがって、本研究のTGD若年者は、ジェンダーアイデンティティに対応する身体活動レベルを有する傾向があった。
身体活動とは対照的に、血清25-ヒドロキシビタミンD、食事性カルシウム摂取量、およびBMI Zスコアは、DFAB群とDMAB群間、あるいは低BMD群と正常BMD群間で有意差は認められなかった。しかし、思春期早期のTGD若年者コホートでは、1日のカルシウム摂取量は全体的に最適ではなかった。文献の大半は、BMDの改善における適切なカルシウム摂取を支持しており [28] 、思春期の早い段階から補給を開始した群 [31] およびベースラインの1日あたりのカルシウム摂取量が少ない群 [32] では、より大きな改善がみられる。また、思春期が遅く、ベースラインでの1日あたりのカルシウム摂取量が多い人でも、改善がみられる [33] 。これらの結果は、BMDを改善するための潜在的な介入として、食事からのカルシウムおよびビタミンDの摂取を最適化するための標準的な推奨事項や、思春期前から思春期早期の時期に開始可能なウエイトトレーニング運動を増加させることが重要であることを示唆している [34-36] 。さらに、BMI Zスコアは、TBLH施設におけるBMD Zスコアの有意な正の予測因子であったことから、摂食障害のスクリーニングのために身体活動および食歴の慎重な評価を行うべきであり [37] 、特に低BMDが認められた場合に行うべきであるという説が補強された。
本研究の長所には、トランスジェンダーの若年者においてこれまで報告されていない、食事からのカルシウム摂取、身体活動、およびビタミンDの状態の評価が含まれる。本研究の限界は、トランスユースケア研究が観察的かつ多施設であることに関連しており、BMD測定がすべての施設で標準化されていないことである。この限界にもかかわらず、われわれは異なる画像モダリティ間で同等の結果を得ており、われわれの所見の確かさを裏付けている。現在のところ、トランスジェンダーの若年者における骨折データは報告されていないため、BMD Zスコアは将来の骨折リスクを推定するための唯一の代用指標である。
身長の伸びが完了した後に、有意な骨塩量増加が起こることが示されている [30] 。思春期の開始時期が遅れると成人の骨塩量が低下するように、思春期の時期が骨塩量のピークに影響するため [38-40] 、このコホートの骨格画像診断を継続しながら長期的に追跡調査することは、これらの若年者がGnRHa治療、さらに異性化ステロイド剤による治療に進むにつれて、骨塩量の増加の軌跡を理解する上で極めて重要である。この治療前分析から得られた知見は、経時的な縦断的評価によってフォローアップされ、現在の治療およびモニタリングプロトコールにさらに情報を提供することになるであろう。
謝辞
トランスユースケア研究に参加してくれた研究参加者とその家族、および臨床研究コーディネーターに感謝する。骨密度測定の解析に関して貴重な助言をいただいたBo Fan医学博士とEllen Fung RD, CCD博士に感謝する。
財政的支援:本書で報告された研究は、米国国立衛生研究所のEunice Kennedy Shriver National Institute of Child Health and Human Development(賞番号R01HD082554およびF32HD098763)の支援を受けた。内容はあくまで著者らの責任によるものであり、必ずしも米国国立衛生研究所の公式見解を示すものではない。
追加情報
開示事項要約:J.Y.L.、C.F.、J.O.-K.、R.G.およびD.V.G.は、開示すべき関連する金銭的利害関係を有していない。Y.-M.C.およびS.M.R.は、Endo Pharmaceuticalsのアドバイザリーボードを務めている。
データの利用可能性:本試験で作成または解析されたデータは、患者の秘密を保持するため、またはライセンスに基づき使用されたものであるため、入手に制限が適用される。本データは、患者の機密保持のため、またはライセンスに基づき使用されるため、本試験中に生成または解析されたデータには制限が適用される。
References and Notes
1. Herman JL, Flores AR, Brown TNT, Wilson BDM, Conron KJ Age of Individuals Who Identify as Transgender in the United States. Los Angeles, CA: The Williams Institute: UCLA School of Law; 2017:1-13.
Google Scholar Google Preview WorldCat COPAC
2. Rider GN, McMorris BJ, Gower AL, Coleman E, Eisenberg ME. Health and care utilization of transgender and gender nonconforming youth: a population-based study. Pediatrics. 2018;141(3):1-8.
Google Scholar Crossref WorldCat
3. Johns MM, Lowry R, Andrzejewski J, et al. Transgender identity and experiences of violence victimization, substance use, suicide risk, and sexual risk behaviors among high school students - 19 states and large urban school districts, 2017. MMWR Morb Mortal Wkly Rep. 2019;68(3):67-71.
Google Scholar Crossref PubMed WorldCat
4. Edwards-Leeper L, Spack NP. Psychological evaluation and medical treatment of transgender youth in an interdisciplinary “Gender Management Service” (GeMS) in a major pediatric center. J Homosex. 2012;59(3):321-336.
Google Scholar Crossref PubMed WorldCat
5. Hsieh S, Leininger J. Resource list: clinical care programs for gender-nonconforming children and adolescents. Pediatr Ann. 2014;43(6):238-244.
Google Scholar Crossref PubMed WorldCat
6. American Psychiatric Association. American Psychiatric Association. DSM-5 Task Force. Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. Washington, D.C.: American Psychiatric Association.
Google Scholar Google Preview WorldCat COPAC
7. Hembree WC, Cohen-Kettenis PT, Gooren L, et al. Endocrine treatment of gender-dysphoric/gender-incongruent persons: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab.. 2017;102(11):1-35.
Google Scholar Crossref PubMed WorldCat
8. Coleman E, Bockting W, Botzer M, et al. Standards of care for the health of transsexual, transgender, and gender-nonconforming people, version 7. Int J Transgender. 2012;13(4):165-232.
Google Scholar Crossref WorldCat
9. Klink D, Caris M, Heijboer A, van Trotsenburg M, Rotteveel J. Bone mass in young adulthood following gonadotropin-releasing hormone analog treatment and cross-sex hormone treatment in adolescents with gender dysphoria. J Clin Endocrinol Metab. 2015;100(2):E270-E275.
Google Scholar Crossref PubMedWorldCat
10. Vlot MC, Klink DT, den Heijer M, Blankenstein MA, Rotteveel J, Heijboer AC. Effect of pubertal suppression and cross-sex hormone therapy on bone turnover markers and bone mineral apparent density (BMAD) in transgender adolescents. Bone. 2017;95:11-19.
Google Scholar Crossref PubMed WorldCat
11. Haraldsen IR, Haug E, Falch J, Egeland T, Opjordsmoen S. Cross-sex pattern of bone mineral density in early onset gender identity disorder. Horm Behav. 2007;52(3):334-343.
Google Scholar Crossref PubMed WorldCat
12. Van Caenegem E, Taes Y, Wierckx K, et al. Low bone mass is prevalent in male-to-female transsexual persons before the start of cross-sex hormonal therapy and gonadectomy. Bone. 2013;54(1):92-97.
Google Scholar Crossref PubMed WorldCat
13. Wierckx K, Mueller S, Weyers S, et al. Long-term evaluation of cross-sex hormone treatment in transsexual persons. J Sex Med. 2012;9(10):2641-2651.
Google Scholar Crossref PubMed WorldCat
14. Joseph T, Ting J, Butler G. The effect of GnRH analogue treatment on bone mineral density in young adolescents with gender dysphoria: findings from a large national cohort. J Pediatr Endocrinol Metab. 2019;32(10):1077-1081.
Google Scholar Crossref PubMed WorldCat
15. Stoffers IE, de Vries MC, Hannema SE. Physical changes, laboratory parameters, and bone mineral density during testosterone treatment in adolescents with gender dysphoria. J Sex Med. 2019;16(9):1459-1468.
Google Scholar Crossref PubMed WorldCat
16. Turban JL, Ehrensaft D. Research review: gender identity in youth: treatment paradigms and controversies. J Child Psychol Psychiatry. 2018;59(12):1228-1243.
Google Scholar Crossref PubMed WorldCat
17. Olson-Kennedy J, Chan YM, Garofalo R, et al. Impact of early medical treatment for transgender youth: protocol for the longitudinal, observational trans youth care study. JMIR Res Protoc. 2019;8(7):e14434.
Google Scholar Crossref PubMed WorldCat
18. Gilsanz V, Perez FJ, Campbell PP, Dorey FJ, Lee DC, Wren TA. Quantitative CT reference values for vertebral trabecular bone density in children and young adults. Radiology. 2009;250(1):222-227.
Google Scholar Crossref PubMed WorldCat
19. Zemel BS, Kalkwarf HJ, Gilsanz V, et al. Revised reference curves for bone mineral content and areal bone mineral density according to age and sex for black and non-black children: results of the bone mineral density in childhood study. J Clin Endocrinol Metab. 2011;96(10):3160-3169.
Google Scholar Crossref PubMed WorldCat
20. Lee JY, Finlayson C, Olson-Kennedy J, et al. Supplemental data: Low bone mineral density in early pubertal transgender/gender diverse youth: findings from the Trans Youth Care Study. Dryad Digital Repository 2020. Deposited 7 May 2020. https://doi.org/10.7272/Q6N29V5N
Google Scholar Google Preview WorldCat COPAC
21. Crocker PR, Bailey DA, Faulkner RA, Kowalski KC, McGrath R. Measuring general levels of physical activity: preliminary evidence for the physical activity questionnaire for older children. Med Sci Sports Exerc. 1997;29(10):1344-1349.
Google Scholar Crossref PubMed WorldCat
22. Kowalski KC, Crocker PRE, Faulkner RA. Validation of the physical activity questionnaire for older children. Pediatr Exerc Sci. 1997;9(2):174-186.
Google Scholar Crossref WorldCat
23. StataCorp. Stata Statistical Software. Vol Release 16. College Station, TX: StataCorp LLC; 2019.
Google Scholar Google Preview WorldCat COPAC
24. Munns CF, Shaw N, Kiely M, et al. Global consensus recommendations on prevention and management of nutritional rickets. J Clin Endocrinol Metab. 2016;101(2):394-415.
Google Scholar Crossref PubMed WorldCat
25. Ross AC, Manson JE, Abrams SA, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab. 2011;96(1):53-58.
Google Scholar Crossref PubMed WorldCat
26. Bailey RL, Dodd KW, Goldman JA, et al. Estimation of total usual calcium and vitamin D intakes in the United States. J Nutr. 2010;140(4):817-822.
Google Scholar Crossref PubMed WorldCat
27. Smith C, Clark AF, Wilk P, Tucker P, Gilliland JA. Assessing the effectiveness of a naturally occurring population-level physical activity intervention for children. Public Health. 2020;178:62-71.
Google Scholar Crossref PubMed WorldCat
28. Weaver CM, Gordon CM, Janz KF, et al. The National Osteoporosis Foundation’s position statement on peak bone mass development and lifestyle factors: a systematic review and implementation recommendations. Osteoporos Int. 2016;27(4):1281-1386.
Google Scholar Crossref PubMed WorldCat
29. 2019 ISCD Official Positions - Pediatric. The International Society for Clinical Densitometry. 2019.
Google Scholar Google Preview WorldCat COPAC
30. McCormack SE, Cousminer DL, Chesi A, et al. Association between linear growth and bone accrual in a diverse cohort of children and adolescents. JAMA Pediatr. 2017;171(9):e171769.
Google Scholar Crossref PubMed WorldCat
31. Cameron MA, Paton LM, Nowson CA, Margerison C, Frame M, Wark JD. The effect of calcium supplementation on bone density in premenarcheal females: a co-twin approach. J Clin Endocrinol Metab. 2004;89(10):4916-4922.
Google Scholar Crossref PubMed WorldCat
32. Dibba B, Prentice A, Ceesay M, Stirling DM, Cole TJ, Poskitt EM. Effect of calcium supplementation on bone mineral accretion in Gambian children accustomed to a low-calcium diet. Am J Clin Nutr. 2000;71(2):544-549.
Google Scholar Crossref PubMed WorldCat
33. Prentice A, Ginty F, Stear SJ, Jones SC, Laskey MA, Cole TJ. Calcium supplementation increases stature and bone mineral mass of 16- to 18-year-old boys. J Clin Endocrinol Metab. 2005;90(6):3153-3161.
Google Scholar Crossref PubMed WorldCat
34. Kannus P, Haapasalo H, Sankelo M, et al. Effect of starting age of physical activity on bone mass in the dominant arm of tennis and squash players. Ann Intern Med. 1995;123(1):27-31.
Google Scholar Crossref PubMed WorldCat
35. Gunter K, Baxter-Jones AD, Mirwald RL, et al. Impact exercise increases BMC during growth: an 8-year longitudinal study. J Bone Miner Res. 2008;23(7):986-993.
Google Scholar Crossref PubMed WorldCat
36. Lappe JM, Watson P, Gilsanz V, et al. The longitudinal effects of physical activity and dietary calcium on bone mass accrual across stages of pubertal development. J Bone Miner Res. 2015;30(1):156-164.
Google Scholar Crossref PubMed WorldCat
37. Coelho JS, Suen J, Clark BA, Marshall SK, Geller J, Lam PY. Eating disorder diagnoses and symptom presentation in transgender youth: a scoping review. Curr Psychiatry Rep. 2019;21(11):107.
Google Scholar Crossref PubMed WorldCat
38. Gilsanz V, Chalfant J, Kalkwarf H, et al. Age at onset of puberty predicts bone mass in young adulthood. J Pediatr. 2011;158(1):100-105, 105 e101-102.
Google Scholar Crossref PubMed WorldCat
39. Elhakeem A, Frysz M, Tilling K, Tobias JH, Lawlor DA. Association between age at puberty and bone accrual from 10 to 25 years of age. JAMA Netw Open. 2019;2(8):e198918.
Google Scholar Crossref PubMed WorldCat
40. Cousminer DL, Mitchell JA, Chesi A, et al. Genetically determined later puberty impacts lowered bone mineral density in childhood and adulthood. J Bone Miner Res. 2018;33(3):430-436.
Google Scholar Crossref PubMed WorldCat
© Endocrine Society 2020.
This is an Open Access article distributed under the terms of the Creative Commons Attribution-NonCommercial-NoDerivs licence (http://creativecommons.org/licenses/by-nc-nd/4.0/), which permits non-commercial reproduction and distribution of the work, in any medium, provided the original work is not altered or transformed in any way, and that the work is properly cited. For commercial re-use, please contact journals.permissions@oup.com