C-1-001
原文
Klink, D., Caris, M., Heijboer, A., van Trotsenburg, M., & Rotteveel, J. (2015).
Bone Mass in Young Adulthood Following Gonadotropin-Releasing Hormone Analog Treatment and Cross-Sex Hormone Treatment in Adolescents With Gender Dysphoria.
The Journal of Clinical Endocrinology & Metabolism, 100(2), E270–E275.
https://doi.org/10.1210/jc.2014-2439
抄録
性ステロイドは骨量の増加に重要である。ゴナドトロピン放出ホルモン療法を受けたジェンダー違和(性別違和:Gender dysphoria:GD)の思春期の若者は、異性化ホルモン(CSH)を追加するまで、一時的に性ステロイドが欠乏する。この治療がその後の人生における骨密度(BMD)に及ぼす影響は不明である。
目的
本研究の目的は、思春期に性別再割り当て(SR)を開始したGDの思春期の若者において、GnRHa治療中および22歳時のBMDの発達を評価することである。
デザインと設定
本研究は3次紹介施設における長期的観察研究である。
対象者
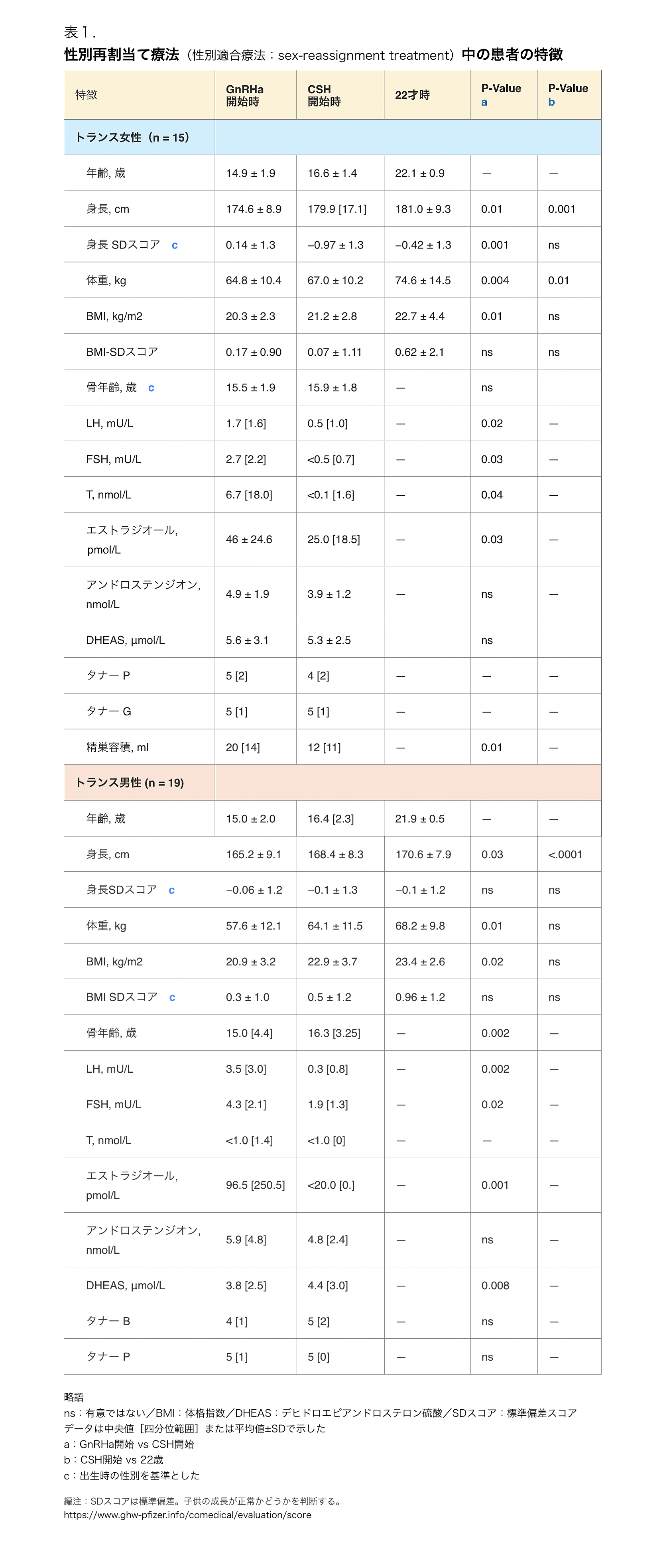
ジェンダーアイデンティティー障害(性同一性障害:gender identity dysorder)(DSM IV-TR)と診断された若年成人で、思春期にSRを開始し、1998年6月から2012年8月の間に性腺摘出術を受けた者を対象とした。34人の被験者について、22歳までのBMDの発達を解析した。
介入
GnRHa単剤療法(GDを有する生得的男児[トランス女性]およびGDを有する生得的女児[トランス男性]の投与期間中央値はそれぞれ1.3年および1.5年)に続いてCSH療法(トランス女性およびトランス男性の投与期間中央値はそれぞれ5.8年および5.4年)を行い、性腺摘出後はGnRHaの投与を中止した。
主要評価項目
22歳までのSR期間中のBMDの変化。
結果および結論
GnRHa投与開始から22歳までの間に、トランス女性における腰椎aBMDのzスコア(生得的性別を基準として)は-0.8から-1.4へと顕著に減少し、トランス男性では0.2から-0.3へと減少傾向がみられた。このことは、BMDが治療前を基準とした可能値よりも低下していること、骨密度が最高になる時期が遅れたか、あるいは骨密度最高値を得られないことを示唆している。
SEGMによる解説
この後ろ向き研究は、平均年齢22歳のジェンダー違和のある若年成人34人を対象に骨密度(BMD)を調べたものである。この34人は、ゴナドトロピン放出ホルモンアナログ(GnRHa)を1.3~1.5年間投与されて第二次性徴を抑制または遅延させられ、その後異性化ホルモンを約3年間投与された。
この研究の主な知見は、思春期にGnRHaを投与された若年成人は、その後の異性化ホルモン投与にもかかわらず、BMDが低下し、骨量が減少することである。重要なことは、GnRHA投与開始時(平均15歳)、ほとんどの被験者の第二次性徴が比較的遅かったため、骨量の発達の多くがすでに起こっていたことである。より若い年齢でGnRHAを投与された小児や思春期の若者のBMDがどの程度影響を受けるか、また、これらの損失がその後の人生における骨折リスクの増加につながるかどうかはまだわかっていない。
SEGMの平易な言葉による結論
本研究では、思春期中期に第二次性徴抑制剤による治療を受けた若年成人は、第二次性徴抑制剤の投与開始が比較的遅く、その後異性化ホルモンを投与したにもかかわらず、骨密度が低下し、骨量が減少していた。
全文
ジェンダー違和(Gender Dysphoria)をもつ思春期の子どもは、ゴナドトロピン放出ホルモンアナログ(GnRHa)で治療することができる。第二次性徴抑制剤により、出生時の性別の望まない第二次性徴の発現による苦痛を感じることなく、性別違和と向き合うことができる。当センターでは、12歳からGnRHaによる治療が可能である(1)。性転換(SR)願望が持続する場合は、16歳で異性化ホルモン(CSH)を追加する。この治療プロトコルの心理的な利点は明確に証明されている(2)。以前から、GnRHa療法が骨量の発達に及ぼす長期的影響に関する懸念が表明されてきた。GnRHa治療を受けた思春期早発症の小児は、16〜17歳の最終身長到達時に正常な骨量を有している(3-5)。対照的に、GDを有する少年少女は、CSHが追加される少なくとも16歳まではhypogonal(ゴナドトロピン)のままである。GnRHaとCSHの骨密度(BMD)に対する長期的効果は報告されていない。我々は、思春期にGnRHaとCSHによる治療を受けたGDの青少年のピーク骨量(PBM)を評価した。
対象患者と方法
治療プロトコル
患者は、前述のとおり治療された(1)。簡単に説明すると、11.4~18.3歳の性同一性障害(DMS IV-TR)と診断された患者には、トリプトレリン(Decapeptyl-CR、Ferring社製)3.75mgの4週間毎の皮下投与を開始した。15.6~19歳のトランス女性には17-βエストラジオールを段階的に経口投与し、トランス男性には混合Tエステル(Sustanon 250mg/ml、MSD社製)を2~4週間ごとに段階的に投与した。最低18歳で性腺摘出後、GnRHa療法は終了し、CSH療法が継続された。全治療期間中、患者にはカルシウムの摂取とウエイトトレーニングを推奨した。
研究対象者
研究対象者は、21歳以上であり、1998年6月から2012年8月までの期間に性腺摘出術が行われており、GnRHa治療開始時、CSH治療開始時、および22歳時点のBMDに関するデータが入手可能な場合に対象として採用された。また対象となった34人の被験者とその両親または法定代理人から、治療開始時の追跡調査について書面による同意を得た。
腰椎(LS)および大腿骨領域(非利き側)(FN)の面骨密度(aBMD、g/cm2)を、前述の時点で二重エネルギーX線吸収測定装置(Hologic QDR 4500、Hologic社製)により測定した。研究期間中、Hologic社の装置は2004年7月に更新され、2011年2月に交換された。出生時の性別、年齢、人種に応じたaBMDのzスコアは、National Health and Nutrition Examination Surveyの参考文献(6)に基づいており、研究期間中に変更はなかった。
LSのzスコアは研究開始から入手可能であったが、FNのzスコアは研究開始から5年後の2003年に入手可能となった。LSとFNの体積BMD(骨塩量見かけ密度[BMAD])は既述のように算出し、zスコアは英国の参照集団を用いて決定した(7)。青年期のBMADの基準値は入手できない。BMADで表される腰椎PBMは、女性では18~20歳、男性では18~23歳で達成される(8)。したがって、22歳のLS BMADのzスコアを算出するために、17歳のLS BMADを基準とした。人体計測、骨年齢、ホルモン値については補足データに記載されている。
統計分析
統計解析にはSPSS Version 22(IBM)を使用した。正規分布のデータは平均値±SDで表し、対応ありt検定と事後検定ボンフェローニ補正で比較した。正規分布でないデータは中央値および四分位範囲で表し、比較にはウィルコクソンの符号順位検定を用いた。相関分析では、正規分布のデータについてピアソンの相関係数(ρ)を算出した。データが正規分布していない場合は、スピアマンの順位相関係数を計算した。P < .05を統計的に有意とみなした。
結果
研究集団
臨床的特徴を表1にまとめた。トランス女性およびトランス男性におけるGnRHa単剤療法の期間中央値は、それぞれ1.3年(範囲、0.5-3.8)および1.5年(範囲、0.25-5.2)であった。CSH療法の期間中央値はそれぞれ5.8年(範囲、3.0-8.0)および5.4年(範囲、2.8-7.8)であった。GnRHa療法とCSH療法の併用期間の中央値はそれぞれ3.1年(範囲、2.1-4.5)および2.2年(範囲、1.4-3.1)であった。
表1. 性別再割当て療法(性別適合療法:sex-reassignment treatment)中の患者の特徴
骨密度の変化
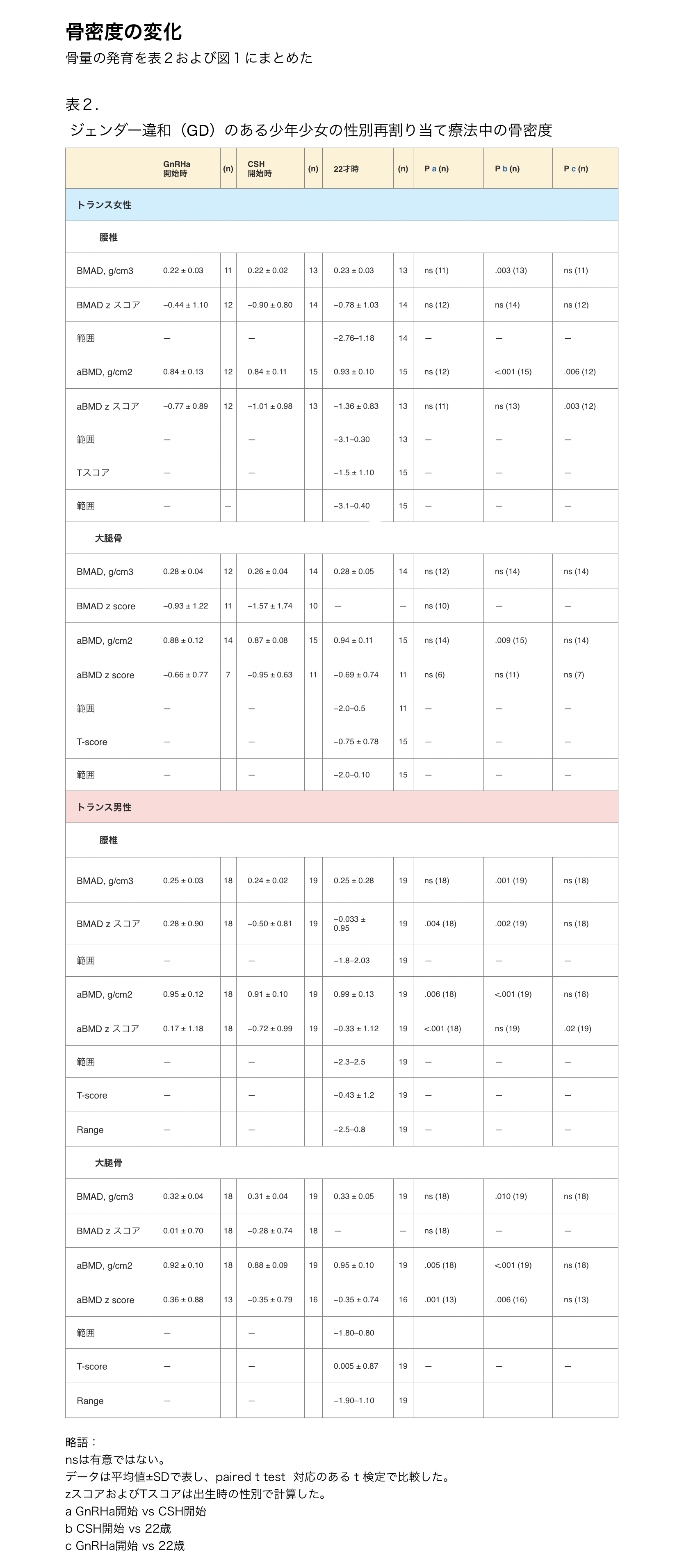
骨量の発達を表2および図1にまとめた。
表2.ジェンダー違和(GD)のある少年少女の性別再割り当て療法中の骨密度
図1
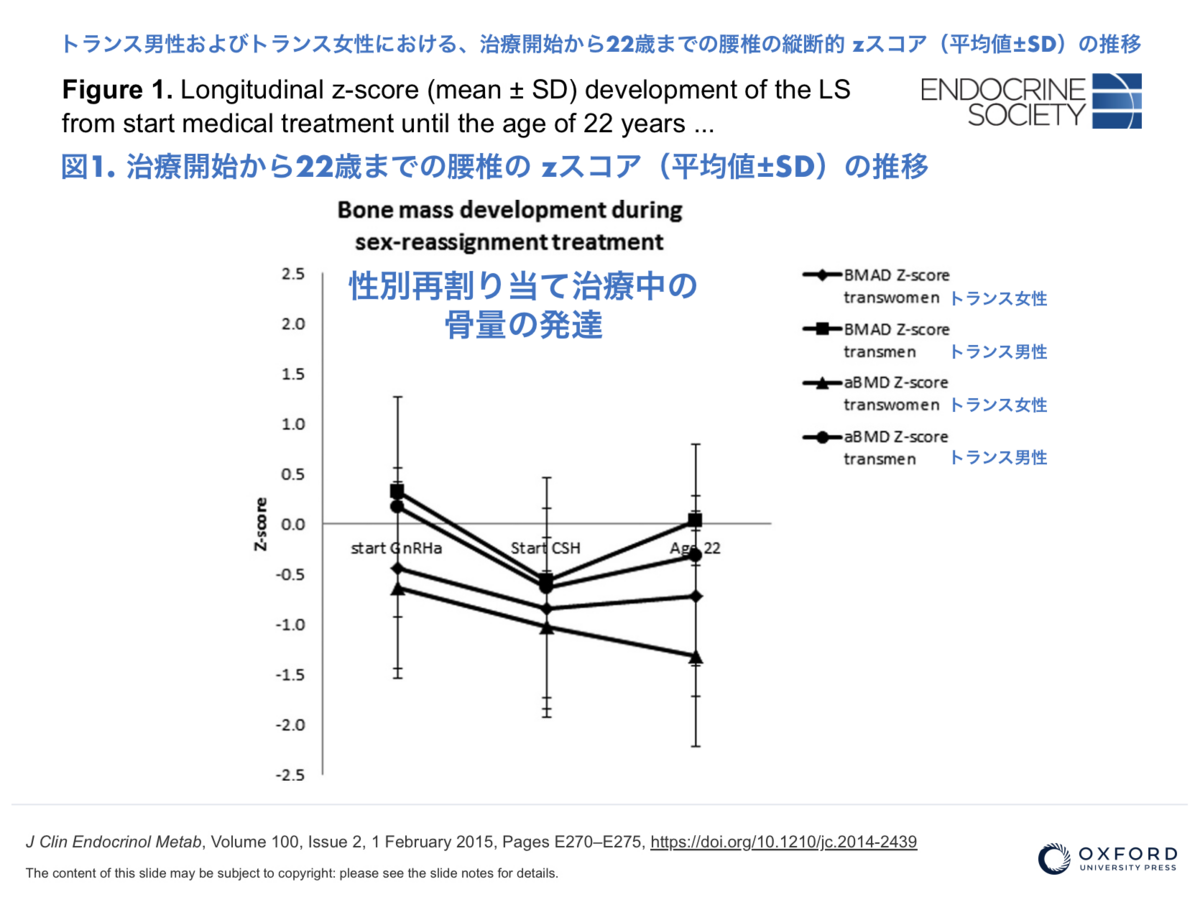
トランス女性では、絶対的aBMDとBMADはGnRHa単剤療法中変化せず、それぞれのzスコアは減少したが有意ではなかった。CSH期間中、LSの絶対aBMDは増加したが、22歳時のzスコアは治療開始時よりも低かった。
トランス男性では、LSおよびFNの絶対的aBMDとそれぞれのzスコアはともにGnRHa単剤療法中に減少し、その後CSH療法開始から22歳までの間に増加した。22歳では、LSのaBMDのzスコアはGnRHa治療開始時と比較して低かったが、これは有意ではなかった。
トランス女性およびトランス男性におけるGnRHa単剤療法の期間は、22歳時点でのBMD、BMADおよびそれぞれのzスコアと相関しなかった。
22歳の時点で、トランス女性6人(40%)のLS aBMD zスコアは<-2であった。さらに、5人のトランス女性(33%)がTスコア<-1および>-2.5、3人(20%)がTスコア<2.5であった。トランス男性では、それぞれ1人(5%)、5人(26%)、0人であった。
これらの被験者、および若年成人期の二重エネルギーX線吸収測定が利用できなかった44人の追加被験者におけるGnRHa単剤療法中のBMD発達については、補足データに記載されている。
議論
本研究の主な知見は、若年期にGnRHa治療を受けた若年成人のトランス女性は、治療前と比較してLSのaBMDのzスコアが低下していることである。トランス男性においても、このzスコアの低下は傾向として観察された。さらに、両群とも、LSとFNの絶対骨量はGnRHa単独療法中に減少し、その後CSH開始後に増加した。
世界保健機関(WHO)の分類によると、両群ともTスコアによってosteopenic骨減少症に分類される人がいた(6)。しかし、Tスコアは主に中年齢の患者に関連するものであり、本研究では年齢、民族、性で正規化したzスコアを用いるのがより適切である。骨の皮質の大きさと質は思春期と青年期に決定されるため(9, 10)、トランスジェンダー成人の骨量に関する最近の研究(11, 12)と一致する。成人では、BMDの絶対値を経時的に比較することが好ましいかもしれないが、我々の被験者では、BMDは通常経時的に増加するため、絶対値の比較はあまり意味がなく、したがってzスコアの比較がより適切である。出生時の性別のzスコアを使用する場合は、アンドロゲンとエストロゲンが骨に異なる影響を与えることを考慮する必要があり(13)、トランスジェンダー集団の骨特性は、年齢と出生時の性別が一致する対照集団とは異なることが示されている(11, 12, 14)。
トランス女性では、治療開始時のLS aBMD zスコアは集団平均を下回っていた。この所見は、トランス女性集団における過去の報告(15,16)と一致している。若いトランス女性は、出生時の性別に典型的なスポーツ活動を行うことに抵抗を感じる可能性が考えられる。CSH治療中、LSのaBMD zスコアは増加しなかったが、これはエストロゲンの初期投与量が比較的少なかったためと考えられる。実際、より高用量が必要であることが報告されている(17, 18)。
トランス男性では、LSの絶対aBMDとzスコアは、治療開始時には正常であったが、GnRHa単剤治療中に減少した。これは、治療開始時に思春期が進行しており、骨量維持のための性ステロイドへの依存度が高くなっていることを反映している可能性がある。トランス女性とは対照的に、トランス男性ではCSH下でLSのaBMD zスコアが改善したが、これは急速な増量が可能なCSHスキームによるものと考えられる。しかし、治療前のzスコアは22歳の時点では到達していなかった。このことは、T維持療法を2-3年続けると骨量が減少すると報告した成人トランスジェンダー集団における先行研究と一致している(19)。
これらの知見と骨折リスクとの関連性は明らかではない。現時点では、成人になって性別再割り当てを行ったトランスジェンダー集団(16)と同様に、青年期のGD患者においても、医学的介入がその後の人生における骨折リスクの増加につながるかどうかは不明である。さらに、本研究の制約も考慮しなければならない。
第一に、プライマリーアウトカムが22歳時の骨量であり、22歳時のデータが完全に得られている被験者が34人しかいなかったため、本研究の所見は慎重に解釈すべきである。第2に、22歳時点での骨量の減少が、GnRHaの投与期間、CSHの初期低用量計画、あるいはCSHの薬力学的特性のいずれに起因するかは決定できなかった。ほとんどの患者は開始時に思春期後期であったため、骨量の発達の一部はすでに起こっており、GnRHa単剤療法はCSH療法開始前の比較的短い期間であった。後者は、GnRHa単剤療法の期間と22歳時点の骨量との間に相関が認められなかった理由を説明するかもしれない。GnRHa治療の寄与はせいぜい暫定的なものである。
第3に、zスコアに関するデータは限られていた。研究開始時点では、FN aBMDのzスコアは入手不可能であり、治療前から22歳まで比較できた被験者は少数であった。BMADのzスコアは成人では入手できないが(7)、LS BMADのPBMは10年目の終わりに達成されることが証明されたので、17歳を代用とした。女性のPBM到達が18歳前後と早いことを考えると(8)、これはトランス男性にとってより適切であった。男性ではPBMに達するのが遅いため(8)、LS BMAD zスコアは過大評価される可能性がある。第4に、我々の研究では、食事からのカルシウム摂取量、ビタミンDレベル、ウエイトトレーニング運動(20)など、骨量増加に影響する他の因子に関する情報が不足していた。患者には乳製品の摂取と運動について強く勧めたが、これらの因子は記録されなかった。
今後の研究では、ビタミンD値の連続測定、標準化された質問票を用いた乳製品摂取量と運動量の評価を行うべきである(12)。
これらの制限にもかかわらず、我々の所見は、現在当院で治療を受けている患者のほとんどが、他のトランスジェンダー集団で観察されるように、GnRHa治療開始時に思春期後期であることを考えると、適切である(21, 22)。CSHを16歳以降に延期する場合、これらの対象者は特に骨量が減少しやすいことを考慮すべきである。加えて、より "理想的な "思春期、すなわちTannerステージ2-3で発症した被験者では、骨の健康が長期的に損なわれる可能性に対する懸念が増幅される可能性がある。
結論として、本研究は、GDを有する若年期の早期医療介入の骨量に関する最初の研究であり、22歳時のLS BMD zスコアの低下を示している。この減少は、PBM達成の遅延またはPBM潜在能の喪失のいずれかを反映している可能性があり、GnRHa誘発性性性腺機能低下状態、CSH療法初期における相対的な低ホルモン投与量、またはCSHの薬力学的特性に起因している可能性がある。この集団における骨量発達の継続的モニタリングは、できればトランスジェンダーの医療経験があり、青年期の治療プロトコールを熟知した内分泌専門医によって行われることが望ましい。
Acknowledgments
Disclosure Summary: The authors have nothing to disclose.
Abbreviations
aBMD:areal bone mineral density
BMAD:bone mineral apparent density
BMD:bone mineral density
CSH:cross sex hormones
FN:femoral region
GD:gender dysphoria
GnRHa:gonadotropin releasing hormone analog
LS:lumbar spine
PBM:peak bone mass
SR:sex reassignment
References