C-1-005
原文
Delgado-Ruiz, R., Swanson, P., & Romanos, G. (2019).
Systematic Review of the Long-Term Effects of Transgender Hormone Therapy on Bone Markers and Bone Mineral Density and Their Potential Effects in Implant Therapy.
Journal of Clinical Medicine, 8(6), 784.
1. 序論
「トランスジェンダー」という用語は、身体的性徴(割り当てられたジェンダー)とジェンダーアイデンティティー(ある性別の他者と同じであることを経験する程度)の不調和を経験する集団を表す[1]。場合によっては、割り当てられたジェンダーとジェンダーアイデンティティーの不調和の結果として、身体的または精神的な健康問題を伴う苦痛(ジェンダー違和)を被ることがある [2]。
ジェンダー違和を経験する患者は様々な要求を持って現れる。これらの患者には、様々な専門医のサポートを受けながら異性への移行を必要とする対象者、生物学的変容を伴わずにステレオタイプな役割の外で生きることを熱望する患者、性別以外の健康問題で医療ケアを必要とする個人、精神医学的サポートを必要とする患者などが含まれる [3] 。異性への移行を希望する対象者は通常、第二次性徴を特徴づける薬物療法を受け、ジェンダー再割り当てのための外科手術を受けることもある [4] 。
ジェンダー移行のための薬物療法は、患者の性腺軸を部分的または完全に抑制し、二次性徴を増加させることを目的としたホルモン療法と非ホルモン療法に基づいている [5,6] 。男性から女性(MtF)患者には、ホルモン性エストロゲン製剤(エストラジオールの諸化合物)やスピロノラクトンやゴナドトロピン放出ホルモン作動薬(GnRH)などの抗アンドロゲンが使用される [7] 。スピロノラクトンは、アンドロゲン受容体を阻害するため、アンドロゲンに対する反応を低下させ、女性化効果を持ち、顔面毛を減少させ、男性脱毛症を遅らせる。さらに、スピロノラクトンはエストロゲンの摂取に相加的な効果をもたらすため、エストロゲンの投与量を減らすことができる(したがって、エストロゲンの高用量投与に伴うリスクを減らすことができる) [8] 。一方、GnRHアゴニストは、黄体形成ホルモンの分泌を抑制することによりテストステロンの分泌を阻害し、性腺抑制をもたらす [7,8] 。
女性から男性(FtM)患者には、テストステロンをベースとした治療と、テストステロンをベースとしない治療がある [9] 。非テストステロン療法には、メドロキシプロゲステロン、GnRHアゴニスト、5α還元酵素阻害薬、選択的セロトニン受容体阻害薬(SSRI)などがある [10] 。これらの療法は、テストステロン療法の副作用を相殺し、ジェンダー移行の他の側面をサポートすることができる。例えば、メドロキシプロゲステロンは月経停止を補助し、GnRHアゴニストは月経や難治性子宮出血を軽減し、5α還元酵素阻害薬やSSRIは毛髪の過成長や脱毛を補助する [9,10,11] 。
しかし、異性にジェンダー移行した、またはジェンダー移行過程にある患者が受けた薬理学的治療の結果として、意図しない全身的な生物学的変化が起こる可能性がある。これには、トランス女性およびトランス男性における心血管リスクの増加 [4]、トランス男性における肥満度指数および収縮期・拡張期血圧の有意な上昇 [12]、トランス女性における腰椎および遠位腕の骨粗鬆症 [13] などが含まれる。また、静脈血栓塞栓症、骨折、心血管系疾患、脳卒中、ホルモン依存性がんなどの副作用も報告されており[14]、最終的には、多少の意見の相違はあるが、トランス男性とトランス女性の患者における骨量、密度、形状の骨粗鬆症的変化も報告されている[15]。
いくつかの研究から、テストステロンとエストロゲンが男女の骨の健康をコントロールするのに不可欠であることが確認されている [16,17,18] 。男性では、テストステロンは骨格の平衡に重要な機能を果たし、エストラジオールは骨格の発達に必要である [17] 。女性では、エストロゲンは骨のホメオスタシスに関与するが、アンドロゲンの影響はあまり明らかでない [16,18] 。このことは、ジェンダー移行によるホルモン療法の結果、骨代謝が変化する可能性を示唆している。
ホルモン療法中は、骨塩密度(BMD)および骨代謝マーカー(BTM)分析により、骨の変化を定期的に計測する。BMDは二重X線吸収測定法(DEXA)により推定され、活発な骨リモデリングを評価するために、BTMは血清中および/または尿中で評価される [19] 。これにより、骨粗鬆症のリスクを予測し、治療経過(骨代謝と骨構造に対する治療の効果)をモニタリングすることができる [20] 。
世界保健機関(WHO)の基準では、Tスコアが<2.5(特定集団のBMDの平均値に対する標準偏差)である場合に、骨粗鬆症が存在すると考えられている [21] 。血清から得られる骨形成のBTMは、オステオカルシン(OC)、総アルカリホスファターゼ(ALP)、骨特異的アルカリホスファターゼ(骨ALP)、プロコラーゲンI型C末端プロペプチド(P1CP)、プロコラーゲンI型N末端プロペプチド(P1NP)である[22]。
一方、骨吸収のためのBTMは、血清から得ることができる(I型コラーゲン架橋C-テロペプチド(sCTX)、I型コラーゲンのカルボキシ末端テロペプチド(ICTP)、酒石酸抵抗性酸性ホスファターゼ(TRACP))、酒石酸耐性酸性ホスファターゼ5b(s-TRACP 5b)、尿(I型コラーゲン架橋N-テロペプチド(uNTX))、I型コラーゲン架橋C-テロペプチド(uCTX)、総ピリドリン(uPYD)、総デオキシピリドリン(uDPD) [23] 。
米国の成人の0.6%近くがトランスジェンダーであると自認しており [24]、世界的なトランスジェンダーの有病率は、英国(0.5%)[25]、ベルギー(0.6%)[26]、オランダ(0.9%)[27]で報告されている。トランスジェンダー集団は、医療へのアクセスに関して困難に直面しており [28]、医療提供者はトランスジェンダーコミュニティに適切に対応するための適切な準備ができていないことが報告されている [28]。
トランスジェンダー患者の口腔ケアに焦点を当てると、この分野の文献は非常に少なく、主に歯科恐怖症[29]やこの話題に関連した歯科教育[30,31,32]が中心となっており、トランスジェンダー患者のフルマウスリハビリテーションに関連した臨床例が1例発表されたのみである[33]。残念ながら、口腔顎顔面外科手術やインプラント処置に関連したトランスジェンダー集団の骨パラメータに関する文献はなく、Ludwigら(2018)が述べているように、"その集団がまだ研究されていない場合、その集団の下位集団にエビデンスに基づいた歯科治療を提供することはできない"。[34].
薬物療法は、チタンインプラントを受けたり、リハビリテーションを受けたり、口腔顎顔面外科処置を受けたりするトランスジェンダー患者の骨構造に影響を及ぼす可能性がある。さらに、これらの治療が骨密度、骨代謝、骨吸収に及ぼす長期的影響は不明である。
したがって、このシステマティックレビューの目的は2つある:
- 第一に、以下のPICOT(問題/患者/集団、介入、比較、結果、時間)の問いに答えることである:長期にわたる薬物療法を受けている成人のトランスジェンダー患者(トランス女性およびトランス男性)において、骨マーカーおよび骨密度は異なる影響を受けるか?
- 第二に、成人のトランスジェンダー患者における長期的な薬物療法が、整形外科や歯科のインプラントを含む治療に与える影響をよりよく理解するための理論的基礎を提供することである。
2.材料と方法
Preferred Reporting Items for Systematic Reviews and Meta-Analyses(PRISMA)ガイドラインに従った[35]。2018年1月から2018年12月にかけて、Medline、EMBASE、PubMedで以下の検索語で電子検索と手動検索を行った:「トランスジェンダー AND 骨の健康」 OR 「トランスジェンダー AND 皮質骨」 OR 「トランスジェンダー AND 海綿骨」 OR 「トランスジェンダー AND 骨構造」 OR 「トランスジェンダー AND 骨代謝」 OR 「トランスジェンダー AND 骨密度」 OR 「トランスジェンダー AND 骨損失」 OR 「異性化ホルモン AND 骨の健康」 OR 「薬物療法 AND トランスジェンダー」 OR 「異性化 AND 皮質骨」 OR 「異性化AND 海綿骨」 OR 「異性化 AND 骨構造」 OR 「異性化 AND 骨代謝」 OR 「異性化 AND 骨密度」 OR 「異性化AND 骨損失」 OR 「異性化 AND 骨の健康」。
さらに、電子検索でヒットしなかった他の報告を特定するため、収録された原稿に記載された参考文献を手動で検索した。
2.1.研究の組み入れ基準
薬理学的治療を受けた成人のトランスジェンダー集団(トランス女性およびトランス男性)を対象に完了した長期臨床研究を、以下の包含基準に従って対象とした:
- 1990年1月から2018年12月までに英語で発表された論文;
- 追跡期間が3年以上の臨床研究を報告した論文;
- トランスジェンダー患者の骨マーカー、骨代謝、骨密度における異性化薬理療法の生物学的効果を報告した論文;
- トランスジェンダー成人に使用された薬理療法を報告した論文(後ろ向き研究と前向き研究の両方を含む)。
研究が重複していると思われる場合は、最も広範な追跡調査を行った研究、または最新の研究のみを対象とした。
2.2.除外基準
- 英語以外の言語で発表された論文;
- 追跡期間が3年未満の論文;
- 10代または若年トランスジェンダー患者における異性化薬理療法の効果を詳述した論文;
- 骨への影響を含まない異性化薬理療法の効果を報告した論文
- 動物実験およびin-vitro試験;
- その他のシステマティックレビューおよびメタアナリシス;
- 重複研究;
- 症例報告
2名の査読者(R.D.およびG.R.)が、検索語を用いて独立に初回検索を行った。最初の検索後、返送された論文のタイトルと抄録を読み、包含基準を満たす論文を選択した。その後、組み入れられた論文の全文を読み、最終的な適格性を評価した。査読者間の意見の相違は、盲検化された第3の査読者(P.S.)の参加により解決された。
2.3.データ抽出
すべての論文から以下の情報を抽出した:
- トランスジェンダーの人口統計:トランスジェンダーの人口統計:各研究に含まれるMtF(トランス女性)、またはFtM(トランス男性)患者の数;
- ホルモン療法の治療期間(年または月単位);
- 患者が受けたホルモンの種類と投与量。
2.3.1.主要評価項目
- 骨代謝マーカー値 カルシウム(mmol/L)、リン酸塩(mmol/L)、アルカリホスファターゼ(U/L)、オステオカルシン(μg/L)の変化。各骨代謝マーカーについて、ベースライン時と治療後、または異なる時点で変化を測定した。
- 骨形成を評価するための血清プロコラーゲンタイプI N末端プロペプチド(PINP)(ng/mL)、骨吸収を評価するための血清コラーゲンタイプI架橋C-テロペプチド(CTX)(ng/mL)を含むBTMの変化を記録した。ベースライン時および各時点での変化を記録した。
BMDの変化。BMD値は、ベースライン時および治療終了後、またはベースライン時および異なる時点で登録された。
得られたデータは、最も古いものから新しいものまで、発表年順に表に整理した。
2.3.2.バイアスのリスク
対象研究のバイアスリスクを判定するために、バイアスリスク評価ツール(RoB 2ツール)[36]を使用した。無作為化プロセス、意図した介入からの逸脱、転帰データの欠落、転帰の測定、報告結果の選択を含む5つの要素(ドメイン)が、各収録論文について評価された。各ドメインを評定し、RoB 2ツール [36] の記述に従って、バイアスのリスクを低リスク、若干の懸念、または高リスクとしてスコア化した。
2.4.統計解析
データの表示には、記述統計、パーセンテージ、平均値、標準偏差、フォレストプロットを用いた。該当する場合は、ランダム効果モデルを用いてメタ解析を行った。統計的比較にはメタ解析ソフトウェア(Comprehensive-Meta-analysis 3.0, Biostat, NJ, USA)を使用した。
3.検索結果
最初の検索で564件の論文がヒットした。タイトルと抄録を読んだ後、471件の論文が除外された。残りの93本の論文を全文読み、84本を除外した(除外基準による)。最終的に、組み入れ基準を満たした9本の論文がこのレビューの対象となった(図1)。
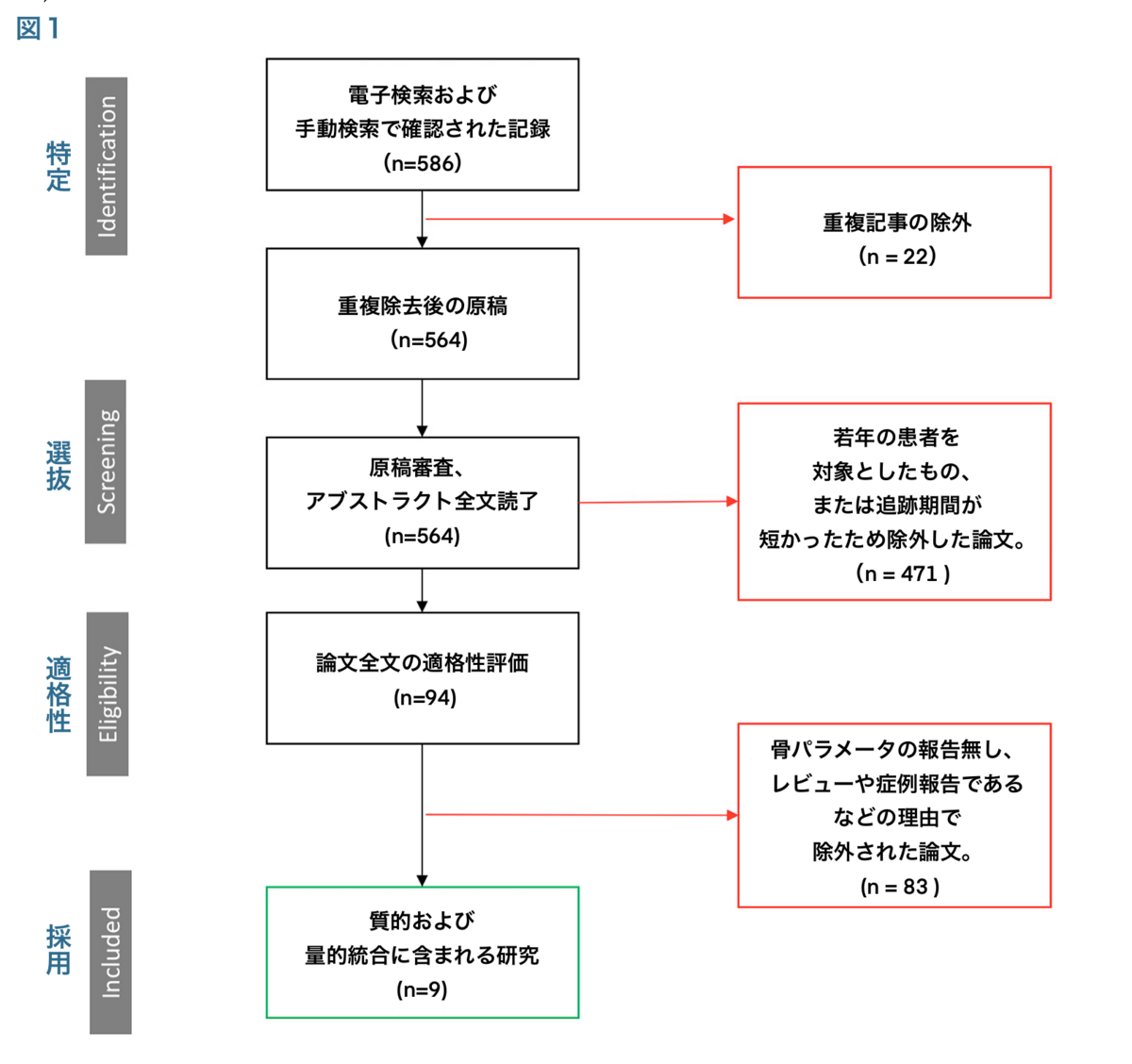
図1. PRISMA(Preferred Reporting Items for Systematic Reviews and Meta-Analyses)のワークフロー。 最初の586の論文から、9つの論文のみが適格基準を満たし、この系統的レビューの対象とされた。
3.1.トランスジェンダーの人口統計と治療期間
3年以上の薬物療法を受けた被験者を対象とした9件の長期研究が対象となった。3件の研究は男性(M)から女性(F)へのトランスジェンダー患者のみを取り上げ、2件の研究はFからMへのトランスジェンダー患者のみを取り上げ、4件の研究は両群(MからF、FからM)を取り上げていた [37,38,39,40,41,42,43,44,45] 。薬物療法に加えて、すべての患者が性別再割り当て手術(sex reassignment surgery)を受けた。評価期間は、最短で3.5年 [40] 、最長で18年 [45] であった。研究対象となった総患者数は1640人(男性から女性へのトランスジェンダー921人、女性から男性へのトランスジェンダー719人)であった(表1)。
表1.人口統計、治療を受けていた期間、投与された薬物。骨構造、骨代謝、骨密度に関する骨密度(BMD)とその評価方法、研究の結論。BMDの薬剤投与量と地域にはばらつきが認められた。Mは男性、Fは女性(表1)。
3.2.投与されたホルモンの種類と投与量
患者が受けた治療方法と投与量は異なっていた。使用された薬剤に基づく研究間の比較は不可能であった。ホルモンの種類/投与量/時間によるばらつき、医療者による調整による治療のばらつき、および個々の患者の特性により、比較は不可能であった。
- MtF
- シプロテロン+エストロゲン(高用量) [37].
- エチニルエストラジオール + 酢酸シプロテロン、経口エストロゲンおよびバレレート型エストラジオール [38]。
- 酢酸シプロテロン2mg/日+エチニルエストラジオール35~100μg/日、性別再割り当て手術後はエストラジオールバレレートまたは17-βエストラジオール2~4mg/日 [39].
- 酢酸シプロテロン50~100mg/日+エチニルエストラジオール25~50μg/日、手術後エチニルエストラジオール25~50μg/日またはエストラジオールバレレート2mg/日または共役ウマエストロゲン1.25mg/日。
- または経皮エストラジオール[40]。
- 酢酸シプロテロン50~100mg/日/1年+外因性エストロゲン、手術後はすべてエストロゲンを投与 [41] 。
- 性腺摘出術までは、エストロゲンと抗アンドロゲン [42] 。
- FtM
いくつかの形態のテストステロンが投与される。
- テストステロンエステル250mg/IMを3週間ごとに、手術の前後に投与する [38].
- デカン酸テストステロン100mg、またはイソカプロ酸テストステロン/フェニルプロピオン酸テストステロン 60mg、またはプロピオン酸テストステロン 30mg/mLを2~3週間、またはウンデカン酸テストステロン 1000mgを12週間、または経皮テストステロン50mgを1日 1回、またはウンデカン酸テストステロン40mg/日+ テストステロンゲル50mg/5g、50mgを1日1回 [41] 。
- テストステロン [42]。
- さまざまなテストステロン化合物 [43].
- イソ酪酸テストステロン、術後はイソ酪酸テストステロン 25mgを1週間ごとに筋肉内投与、またはプロピオン酸テストステロン 250mgを3週間ごとに筋肉内投与、またはウンデカン酸テストステロン 40mgを1日4回投与 [45].
3.3.治療前後の骨代謝マーカー値
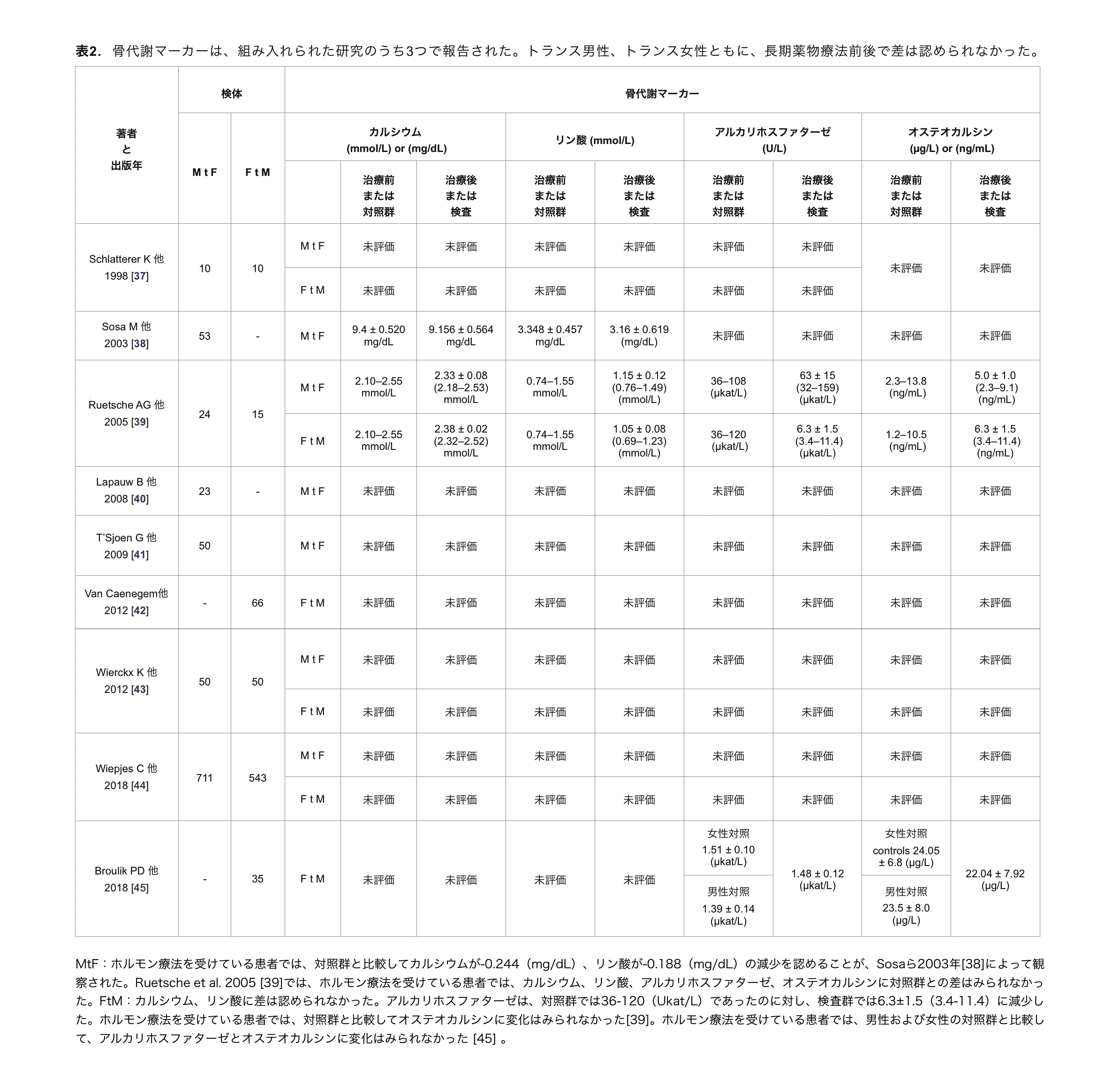
カルシウム、リン酸塩、アルカリホスファターゼ、オステオカルシンが3つの研究で用いられた。母集団や検出方法が異なるため、データを比較することはできなかった。また、測定単位はmg/dLとmmol/Lで異なっていた(表2)。
表2. 骨代謝マーカーは、組み入れられた研究のうち3つで報告された。トランス男性、トランス女性ともに、長期薬物療法前後で差は認められなかった(表2)。
3.4.二つの主要な骨代謝マーカー
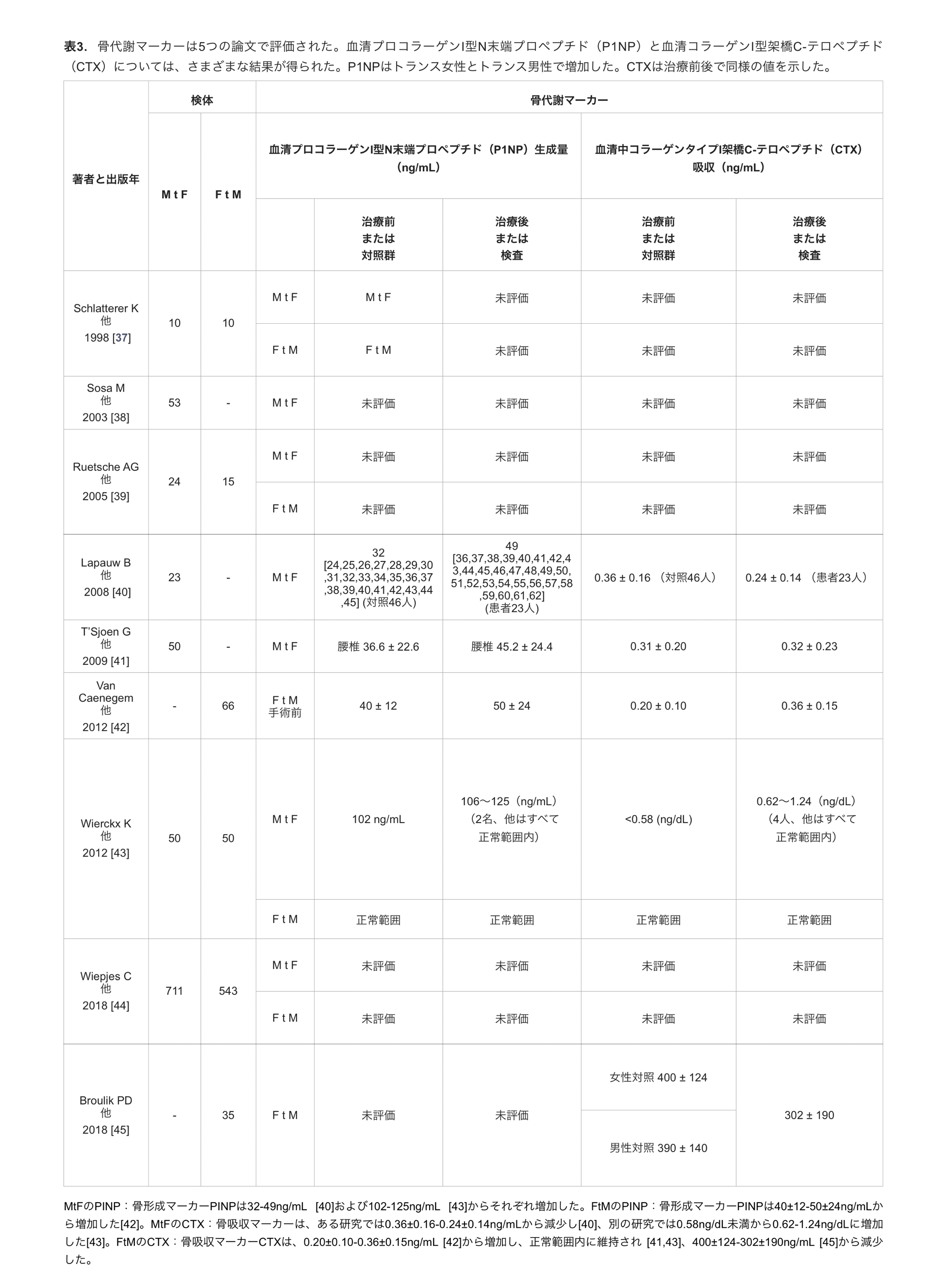
4つの研究 [40,41,42,43]では、両方のマーカー(PINPとCTX)が評価された。一方、CTX単独は1つの研究で評価された[45](表3)。
表3.骨代謝マーカーは5つの論文で評価された。血清プロコラーゲンI型N末端プロペプチド(P1NP)と血清コラーゲンI型架橋C-テロペプチド(CTX)については、さまざまな結果が得られた。P1NPはトランス女性とトランス男性で増加した。CTXは治療前後で同様の値を示した(表3)。
3.5.骨密度(BMD)、評価方法および評価部位
BMDは解剖学的に異なる部位で評価された:腰椎(100%)、大腿骨頸部(60%)、頻度は低いが股関節全体、前腕遠位部、全身 [37,38,39,40,41,42,43,44,45] 。
BMDの評価方法は、二重エネルギーX線吸収測定法(DXA)であった(90%)。また、骨構造の評価には末梢定量的コンピュータ断層撮影法(pQCT)を用いた(10%)[40,41](表1)。
トランス女性(MtF)の薬物療法開始時期に関連するBMD変動を評価すると、14年間で約0.4gr/cm2の範囲であった。一方、トランス男性(FtM)のBMD変動は、9年間で0.6gr/cm2の範囲であった(図2)。
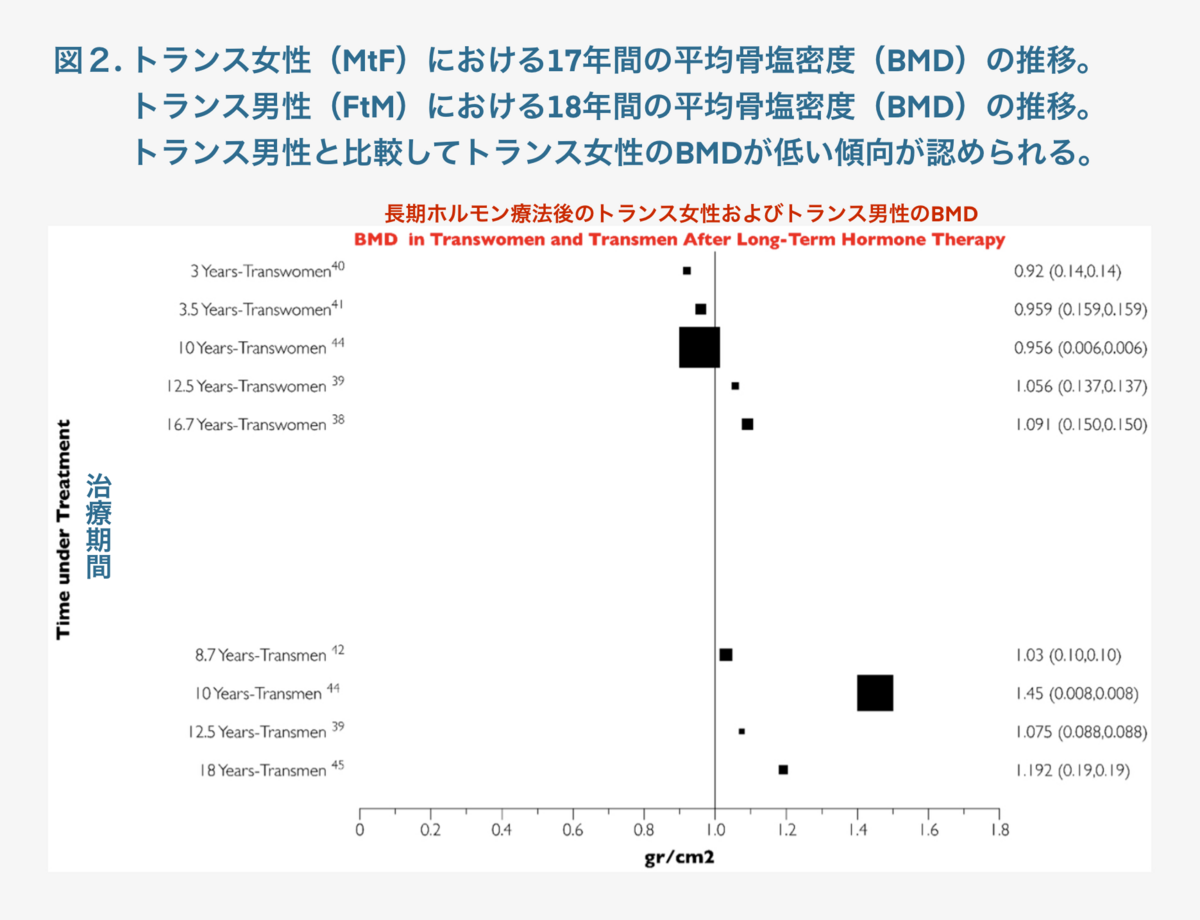
図2. トランス女性(MtF)における17年間の平均骨密度(BMD)の推移。トランス男性(FtM)における18年間の平均骨密度(BMD)の推移。トランス男性と比較してトランス女性のBMDが低い傾向が認められる。
トランス女性の最も長い評価期間(17年間の追跡調査)のBMD値は1.08gr/cm2、トランス男性は1.19gr/cm2(18年間の追跡調査)であった。
3.6.バイアスのリスク評価
9つの研究のいずれも無作為化されておらず(バイアスのリスクが高い)、意図された介入からの逸脱はなく(バイアスのリスクが低い)、アウトカムのデータの少なくとも1つが欠落している研究が8つあり(バイアスのリスクが高い)、測定された場合、アウトカムは適切に評価され(バイアスのリスクが低い)、報告された結果の選択に問題はなかった(バイアスのリスクが低い)。全体として、アウトカムに関する情報の欠落や無作為化の欠如に関する懸念があった(図3)。

図3. バイアスのリスク評価。組み入れられた9件の研究から、8件は何らかの懸念があり、全体的に高いバイアスリスクを示した研究は1件のみであった。S(研究の特定)、Weight(サンプルサイズ/研究ごとの患者数)。
4.考察
このシステマティックレビューの目的は、性転換手術の有無にかかわらず、女性化または男性化のための長期的な薬物療法を受けたトランス女性(MtF)およびトランス男性(FtM)患者の骨マーカーとBMDを評価することである。
得られた情報は、長期的なホルモン療法を受けているトランスジェンダー患者の骨特性について臨床医に参考情報を提供し、この患者集団における将来のインプラント部位とインプラント周囲の骨特性を研究するためのベースラインを提供するかもしれない。
長期的な研究(3年以上)はほとんどなく [37,38,39,40,41,42,43,44,45]、年齢、薬剤と投与量、治療期間、骨代謝の生化学マーカーにかなりの群間ばらつきがあり、統計的な比較ができなかった。したがって、データは可能な限り百分率、平均値、標準偏差で表した。
4.1.トランスジェンダーの人口統計と治療期間
これらのデータは、薬物療法による補充を受けているトランスジェンダー集団の傾向を理解するために集められた。その結果、成人トランスジェンダーのMtF、FtMの集団の人口統計学は同等であり、長期追跡調査は100%ヨーロッパの集団に基づいていることが示された。報告されている最長追跡期間は18年であった[45]。
4.2.受けた薬物療法の種類と投与量
性腺摘出術前後のトランスジェンダー女性(MtF)は、さまざまな形態のエストロゲンとテストステロン抑制剤(酢酸シプロテロンとスピロノラクトン)を受けていた。一方、トランスジェンダー男性(FtM)は、手術前後で主にテストステロン療法を受けていた [37,38,39,40,41,42,43,44,45] 。
異なる投与量と様々な投与方法(口腔内、舌下、筋肉内、パッチ、インプラント、皮下注射)が観察された。薬理学的治療の違いは、治療施設の特定の薬理学的プロトコルに導かれたものよりも、患者中心のアプローチの結果であった [37,38,39,40,41,42,43,44,45] 。
4.3.骨代謝マーカーとインプラント治療への潜在的影響
カルシウムとリン酸塩は、カルシウムのホメオスタシスを担い、酸塩基平衡に関与するほか、骨に埋め込まれた成長因子の放出を促進する [38] 。石灰化した骨基質に対する破骨細胞の作用により、その溶解が促進され、カルシウムイオンが血液中に放出されて血中カルシウムが形成される [46] 。これと並行して、血流に含まれるカルシウムが骨に沈着し、骨芽細胞によって骨カルシウムが形成される。これらの現象は、酵素およびホルモン(ビタミンD、カルシトニン、副甲状腺ホルモン、およびその他の代謝産物)によって制御されている[47]。
異性化ホルモン薬物療法によって代謝の不均衡が生じると、血中カルシウムバランス系が変化し、薬理学的に誘発される骨粗鬆症の病因として重要な役割を果たす。
これらの薬物療法は、リン/カルシウム比を変化させる可能性もある。リンの減少はカルシウムの吸収を変化させ、リン濃度の増加はリン酸塩、カルシウム、ビタミンD間のホルモンバランスだけでなく酸化ストレスを増加させる。
アルカリホスファターゼとオステオカルシンは、いずれも骨形成マーカーである [50,51]。骨アルカリホスファターゼ(ALP)は骨塩化を調節する [51] 。翻訳後修飾によってのみ異なる肝臓ALPアイソフォームも存在する。しかし、モノクローナル抗体を用いた免疫測定法は、骨のアイソフォームをよりよく認識する。一方、オステオカルシンは、骨芽細胞と歯芽細胞によって合成される主要な非コラーゲン性タンパク質であり、その循環レベルは骨形成に非常に特異的である。オステオカルシンは腎臓で分解、排泄される [53] 。
カルシウムとリン酸は骨代謝に不可欠な要素であり、これらの欠乏は骨密度の低下、骨構造の変化(海綿骨間隔の拡大、皮質骨の厚さの減少)、骨粗鬆症、オッセオインテグレーションの遅延をもたらす可能性がある [54] 。すべての骨粗鬆症徴候がカルシウム、リン酸、ビタミンDの欠乏の結果ではないが、これらは最適な骨の健康と関連する重要な因子である [55,56] 。これらの枯渇は、摂取量の低下、ビタミンDの欠乏、疾患や薬剤によって誘発される代謝の変化によっても起こりうる [57,58] 。
今回の検討の結果、トランスジェンダーMtF、FtMの患者に対する長期間の薬物療法後も、カルシウム値、リン酸値、アルカリホスファターゼ値、オステオカルシン値は同程度の値を維持しており、投与された療法がカルシウム/リン酸バランス、アルカリホスファターゼ値、オステオカルシン値に及ぼす影響は最小限であることが示された [37,45] 。
4.4. 主要な骨代謝マーカー2種
国際骨粗鬆症財団(IOF)と国際臨床化学連合(IFCC)による骨代謝(骨吸収と骨形成の 過程)の定量化の推奨に従い、I型プロコラーゲンのN末端プロペプチド(PINP)とI型コラーゲンの C-テロペプチド(CTX-I)が記録された[59]。それぞれ、PINPは骨形成を、CTX-Iは骨吸収を測定する[59]。
この総説によると、ホルモン療法により、MtFの患者ではPINP値が増加し(17ng/mLから23ng/mL)、FtMの患者ではPINPが増加する(>10ng/mL)ことが示された[37,38,39,40,41,42,43,44,45]。一方、MtFおよびFtMのCTX値は一貫していなかった[37,38,39,40,41,42,43,44,45]。
トランスジェンダーホルモン治療中の目標は、抗骨吸収治療の目標と同様であり、骨吸収時にはPINPを少なくとも10ng/mL低下させ、35ng/mL未満とすることである。一方、骨形成期には、PINPを少なくとも10ng/mL上昇させ、69ng/mL以上にすることが目標となる[60]。
したがって、MtFおよびFtMのトランスジェンダー患者に対する長期投与薬物療法は、PINPで評価した骨形成率をわずかに上昇させることができるようである[40,41,42,43]。また、これらのPINP値は、加齢、代謝の変化、非遵守的な治療中断などの要因により、経時的に変化しうることも考慮すべきである[37,38,39,40,41,42,43,44,45]。
4.5.骨塩密度(BMD)
長期の異性化薬物療法を受けているMtFおよびFtMのトランスジェンダー患者のBMD状態は矛盾している。Sosaら(2003)[38]、Ruetscheら(2005)[39]、Van Caenegemら(2012)[42]、Wiepjesら(2018)[44]では、MtF患者もFtM患者も、マッチさせた男性または女性の対照と比較して、BMDが安定または増加している。
著者らは、IGF1(インスリン様成長因子)[39]によって媒介されるエストラジオール[38]の血清レベルの上昇によって媒介される、骨吸収に対するMtF患者におけるエストロゲンの保護効果に基づいて、その所見を説明している。一方、FtMの患者では、BMDの維持または増加は、テストステロン、エストロゲンレベルの低下、および筋肉量の増加の長期的な効果によってもたらされる可能性があり、これらはすべて一緒になって、再吸収率の低下をもたらす可能性がある [38,39,42,44] 。
一方、Schlattererら(1998)[37]、Lapauwら(2007)[40]、T'Sjoenら(2009)[41]、およびWierckxら(2012)[43]によると、MtFの患者ではBMDが低下し、腰椎および腕遠位部の骨粗鬆症の徴候が観察されたが、FtMの患者ではBMDの低下は認められなかった。どうやら、筋肉量の減少、治療への不遵守(アンドロゲン欠乏症の原因となる)、不十分なエストロゲン投与量、座りがちなライフスタイルの影響が、MtFのトランスジェンダー患者が経験した骨吸収をもたらしたようである[37,39,40,41,43](表1)。
4.5.1.BMDの変化と歯科インプラントとの関係の可能性
将来のインプラント床の局所的特性(骨塩量および骨構造)、ならびにインプラントの一次固定(一次安定性)は、微小動揺を軽減し、即時負荷プロトコルを可能にする重要な因子である[61,62]。さらに、骨の質、量、インプラントの形状、手術手技は、微小動 作の有無やインプラントの安定性に影響する因子と考えられている [63]。骨密度が低い場合、インプラントの埋入床の準備中に、 特定のインプラントデザイン(テーパー、セルフタッピング) [64]、アンダードリル、骨凝縮、骨緻密化手技 [65]など、特定の修正を行わない限り、インプラントの一次的な安定性は得られない。
また、低骨密度、骨粗鬆症、インプラントの不具合 [66]、低骨密度とオッセオインテグレーションの低下 [67]との関連性も指摘されている。しかし、最近のシステマティックレビューによると、低骨密度の骨に埋入されたインプラントでは、正常な骨密度の骨に埋入されたインプラントと比較して、無負荷インプラントの生存率と限界骨欠損は同程度であった [68,69]。さらに、骨粗鬆症や骨減少症の患者群にみられた低骨密度は、24ヶ月の追跡調査後、インプラントのオッセオインテグレーションに影響を及ぼさなかったことが報告されている[70]。しかし、インプラントに高い一次安定性が要求される場合(即時荷重プロトコル、シングルボディインプラントなど)、 骨密度は荷重プロトコルを適用する前に考慮すべき因子である [71]。Marquezanらは、BMDとインプラントの一次的安定性には直接的な関連があることを示した(骨密度が増加すると、一次的安定性も増加する)。[71].
4.5.2.トランスジェンダー患者に対するホルモン療法がBMDに及ぼす影響と歯科インプラントとの関係の可能性に関する仮説
異性化薬物療法を長期間受けているMtFのトランスジェンダー患者には、BMDが低下するリスクがあると思われる。したがって、このような患者に歯科インプラント治療を行う際には、骨粗鬆症患者に従った予防措置を考慮すべきである[66,67,68,69]。さらに、本研究で観察された長期間の追跡調査による骨の変化から、トランスジェンダー患者の歯科インプラントを含む処置の前に骨パラメータをモニターすることは妥当であると思われる[72]。最後に、インプラントの長期生存の危険因子(糖尿病、年齢、 喫煙、即時荷重)を考慮すると、BMDはインプラントの生存を決定する最も重要な因子であった(BMD値が低いほど、インプラントの生存率は低くなった)[73]。
4.6.本研究の長所と限界
本論文の長所は、異性化薬物療法が骨代謝マーカー、BTM、BMDに及ぼす影響をまとめた初めての系統的レビューであることである。さらに、データ収集とデータ解析に携わった研究者により、厳密な包含・除外基準と適切な校正が行われた。最後に、長期的なホルモン療法が歯科インプラント治療に及ぼす潜在的影響に関する仮説が提示された。
第一に、対象とした研究数が少なく、統計的比較が不可能であったこと、第二に、短期間(3年未満)の異性化薬物療法の効果および若年患者におけるその効果を除外したことである。さらに、ある時点でこの集団の骨代謝と構造的特徴に影響を与えうる複数の変数(性転換手術と加齢)が、治療法の比較をさらに制限している。
4.7.推奨される今後のステップ
トランスジェンダー患者のホルモン療法が、骨治癒、インプラントのオッセオインテグレーション、インプラント周囲の健康状態、およびインプラントの生存率に及ぼす影響に関する情報が不足しているため、このような情報をまとめた臨床研究が推奨される。
5.結論
このシステマティックレビューの限界の範囲内で、以下の結論を導き出すことができる:
- トランスジェンダー患者に対する長期薬物療法は、カルシウム、リン酸、アルカリホスファターゼ、オステオカルシンの骨マーカーを変化させない。
- トランスジェンダー患者に対する長期薬物療法は、PINPターンオーバーマーカーの増加を伴って発現する骨形成をわずかに増加させる。
- MtFのトランスジェンダー患者に対する長期の異性化薬物療法は、骨密度をわずかに減少させる。
Author Contributions
Conceptualization, R.D.-R., and P.S.; Methodology, R.D.-R., G.R. and P.S.; Software, R.D.-R.; Validation, R.D.-R., G.R. and P.S.; Formal Analysis, R.D.-R., G.R. and P.S.; Investigation, R.D.-R., G.R. and P.S.; Resources, R.D.-R. and G.R.; Data Curation, R.D.-R.,G.R. and P.S.; Writing—Original Draft Preparation, R.D.-R., G.R. and P.S.; Writing—Review & Editing, R.D.-R., G.R. and P.S.; Visualization, R.D.-R., G.R. and P.S.; Supervision, R.D.-R.; Project Administration, R.D.-R., G.R. and P.S.; Funding Acquisition, R.D.-R., G.R.
Conflicts of Interest
The authors declare no conflict of interest.
References
- Beek, T.F.; Cohen-Kettenis, P.T.; Kreukels, B.P. Gender incongruence/gender dysphoria and its classification history. Int. Rev. Psychiatry 2016, 28, 5–12. [Google Scholar] [CrossRef] [PubMed]
- American Psychiatric Association (APA). Diagnostic and Statistical Manual of Mental Disorders, 5th ed.; American Psychiatric Association: Washington, DC, USA, 2013. [Google Scholar]
- Levine, S.B. Ethical concerns about emerging treatment paradigms for gender dysphoria. J. Sex Marital Ther.2018, 44, 29–44. [Google Scholar] [CrossRef]
- Ciccone, M.M.; Loverro, G.; Scicchitano, P.; Loverro, M.; Ricci, G.; Scaramuzzi, F.; Gesualdo, M.; Zito, A.; Campagna, M.; Moncelli, M.; et al. Surgical and pharmacological reassignment: Influence on transsexual cardiovascular risk profile. Intern. Med. J. 2017, 47, 1255–1262. [Google Scholar] [CrossRef] [PubMed]
- Factor, R.J.; Rothblum, E. Exploring gender identity and community among three groups of transgender individuals in the United States: MtFs, FtMs, and genderqueers. Health Sociol. Rev. 2008, 17, 235–253. [Google Scholar] [CrossRef]
- Wilczynski, C.; Emanuele, M.A. Treating a transgender patient: Overview of the guidelines. Postgrad. Med. 2014, 126, 121–128. [Google Scholar] [CrossRef]
- Levy, A.; Crown, A.; Reid, R. Endocrine intervention for transsexuals. Clin. Endocrinol. 2003, 59, 409–418. [Google Scholar] [CrossRef]
- Spack, N.P. Management of transgenderism. JAMA 2013, 309, 478–484. [Google Scholar] [CrossRef] [PubMed]
- Gardner, I.H.; Safer, J.D. Progress on the road to better medical care for transgender patients. Curr. Opin. Endocrinol. Diabetes Obes. 2013, 20, 553–558. [Google Scholar] [CrossRef] [PubMed]
- Hembree, W.C.; Cohen-Kettenis, P.; Delemarre-van de Waal, H.A.; Gooren, L.J.; Meyer, W.J., III; Spack, N.P.; Tangpricha, V.; Montori, V.M. Endocrine treatment of transsexual persons: An Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2009, 94,
3132–3154 . [Google Scholar] [CrossRef] - Meriggiola, M.C.; Berra, M. Safety of hormonal treatment in transgenders. Curr. Opin. Endocrinol. Diabetes Obes. 2013, 20, 565–569. [Google Scholar] [CrossRef] [PubMed]
- Klaver, M.; de Blok, C.J.M.; Wiepjes, C.M.; Nota, N.M.; Dekker, M.J.; de Mutsert, R.; Schreiner, T.; Fisher, A.D.; T’Sjoen, G.; Den Heijer, M. Changes in regional body fat, lean body mass and body shape in trans persons using cross-sex hormonal therapy: results from a multicenter prospective study. Eur. J. Endocrinol.2018, 178, 163–171. [Google Scholar] [CrossRef] [PubMed]
- Mueller, A.; Kiesewetter, F.; Binder, H.; Beckmann, M.W.; Dittrich, R. Long-term administration of testosterone undecanoate every 3 months for testosterone supplementation in female-to-male transsexuals. J. Clin. Endocrinol. Metab. 2007, 92,
3470–3475 . [Google Scholar] [CrossRef] [PubMed] - Smith, K.P.; Madison, C.M.; Milne, N.M. Gonadal suppressive and cross-sex hormone therapy for gender dysphoria in adolescents and adults. Pharmacotherapy 2014, 34, 1282–1297. [Google Scholar] [CrossRef] [PubMed]
- Stevenson, M.; Tangpricha, V. Osteoporosis and Bone Health in Transgender Persons. Endocrinol. Metab. Clin. N. Am. 2019, 48, 421–427. [Google Scholar] [CrossRef] [PubMed]
- Clarke, B.L.; Khosla, S. Androgens and bone. Steroids 2009, 74, 296–305. [Google Scholar] [CrossRef] [PubMed]
- Vandenput, L.; Ohlsson, C. Estrogens as regulators of bone health in men. Nat. Rev. Endocrinol. 2009, 5, 437–443. [Google Scholar] [CrossRef] [PubMed]
- Cauley, J.A. Estrogen and bone health in men and women. Steroids2015, 99 Pt A, 11–15. [Google Scholar] [CrossRef]
- Garnero, P.; Sornay-Rendu, E.; Claustrat, B.; Delmas, P.D. Biochemical markers of bone turnover, endogenous hormones and the risk of fractures in postmenopausal women: The OFELY study. J. Bone Miner. Res. 2000, 15, 1526–1536. [Google Scholar] [CrossRef]
- Szulc, P.; Naylor, K.; Pickering, M.E.; Hoyle, N.; Eastell, R.; Leary, E. Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Ann. Biol. Clin.2018, 76, 373–391. [Google Scholar] [CrossRef]
- Kanis, J.A.; Melton, L.J., 3rd; Christiansen, C.; Johnston, C.C.; Khaltaev, N. The diagnosis of osteoporosis. J. Bone Miner. Res.1994, 9, 1137–1141. [Google Scholar] [CrossRef]
- Biver, E. Use of bone turnover markers in clinical practice. Curr. Opin. Endocrinol. Diabetes Obes.2012, 19, 468–473. [Google Scholar] [CrossRef] [PubMed]
- Flores, A.R.; Herman, J.L.; Gates, G.J.; Brown, T.N. How Many Adults Identify as Transgender in the United States? The Williams Institute: Los Angeles, CA, USA, 2016; Available online: http://williamsinstitute.law.ucla.edu/wp-content/uploads/How-Many-Adults-Identify-as-Transgender-in-the-United-States.pdf (accessed on 20 February 2019).
- Glen, F.; Hurrell, K. Technical Note: Measuring Gender Identity; Equality and Human Rights Commission: Manchester, UK, 2012. [Google Scholar]
- Van Caenegem, E.; Wierckx, K.; Elaut, E.; Buysse, A.; Dewaele, A.; van Nieuwerburgh, F.; de Cuypere, G.; T’Sjoen, G. Prevalence of gender nonconformity in Flanders, Belgium. Arch. Sex. Behav. 2015, 44, 1281–1287. [Google Scholar] [CrossRef] [PubMed]
- Kuyper, L.; Wijsen, C. Gender identities and gender dysphoria in the Netherlands. Arch. Sex. Behav. 2014, 43, 377–385. [Google Scholar] [CrossRef] [PubMed]
- Winter, S.; Diamond, M.; Green, J.; Karasic, D.; Reed, T.; Whittle, S.; Wylie, K. Transgender people: Health at the margins of society. Lancet2016, 388, 390–400. [Google Scholar] [CrossRef]
- Chipkin, S.R.; Kim, F. Ten most important things to know about caring for transgender patients. Am. J. Med.2017, 130, 1238–1245. [Google Scholar] [CrossRef]
- Heima, M.; Heaton, L.J.; Ng, H.H.; Roccoforte, E.C. Dental fear among transgender individuals: A cross sectional survey. Spec. Care Dent.2017, 37, 212–222. [Google Scholar] [CrossRef] [PubMed]
- More, F.G.; Whitehead, A.W.; Gonthier, M. Strategies for student services for lesbian, gay, bisexual, and transgender students in dental schools. J. Dent. Educ. 2004, 68, 623–632. [Google Scholar]
- Temple, H.; Inglehart, M.R. LGBT coverage in U.S. dental schools and dental hygiene programs: Results of a national survey. J. Dent. Educ. 2016, 80, 1440–1449. [Google Scholar]
- Russell, S.; More, F. Addressing health disparities via coordination of care and interprofessional education: Lesbian, gay, bisexual, and transgender health and oral health care. Dent. Clin. 2016, 60, 891–906. [Google Scholar]
- Nishimura, B.J. Treatment considerations for a full mouth reconstruction of a transgender patient. Compend. Contin. Educ. Dent. 2017, 38, 544–551. [Google Scholar]
- Ludwig, D.C.; Morrison, S.D. Should dental care make a transition? J. Am. Dent. Assoc. 2018, 149, 79–80. [Google Scholar] [CrossRef] [PubMed]
- Liberati, A.; Altman, D.G.; Tetzlaff, J.; Mulrow, C.; Gøtzsche, P.C.; Ioannidis, J.P.; Clarke, M.; Devereaux, P.J.; Kleijnen, J.; Moher, D. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: Explanation and elaboration. J. Clin. Epidemiol. 2009, 62, e1–e34. [Google Scholar] [CrossRef] [PubMed]
- Higgins, J.P.T.; Sterne, J.A.C.; Savović, J.; Page, M.J.; Hróbjartsson, A.; Boutron, I.; Reeves, B.; Eldridge, S. A revised tool for assessing risk of bias in randomized trials. Cochrane Database Syst. Rev. 2016, 10 (Suppl. 1), 29–31. [Google Scholar] [CrossRef]
- Schlatterer, K.; Auer, D.; Yassouridis, A.; von Werder, K.; Stalla, G. Transsexualism and osteoporosis. Exp. Clin. Endocrinol. Diabetes 1998, 106, 365–368. [Google Scholar] [CrossRef] [PubMed]
- Sosa, M.; Jódar, E.; Arbelo, E.; Domínguez, C.; Saavedra, P.; Torres, A.; Salido, E.; Gómezde Tejada, M.J.; Hernández, D. Bone mass, bone turnover, vitamin, D.; and estrogen receptor gene polymorphisms in male to female transsexuals: Effects of estrogenic treatment on bone metabolism of the male. J. Clin. Densitom. 2003, 6, 297–304. [Google Scholar] [CrossRef]
- Ruetsche, A.G.; Kneubuehl, R.; Birkhaeuser, M.H.; Lippuner, K. Cortical and trabecular bone mineral density in transsexuals after long-term cross-sex hormonal treatment: A cross-sectional study. Osteoporos Int.2005, 16, 791–798. [Google Scholar] [CrossRef] [PubMed]
- Lapauw, B.; Taes, Y.; Simoens, S.; Van Caenegem, E.; Weyers, S.; Goemaere, S.; Toye, K.; Kaufman, J.M.; T’Sjoen, G.G. Body composition, volumetric and areal bone parameters in male-to-female transsexual persons. Bone 2008, 43, 1016–1021. [Google Scholar] [CrossRef]
- T’Sjoen, G.; Weyers, S.; Taes, Y.; Lapauw, B.; Toye, K.; Goemaere, S.; Kaufman, J. Prevalence of low bone mass in relation to estrogen treatment and body composition in male-to-female transsexual persons. J. Clin. Densitom. 2009, 12, 306–313. [Google Scholar] [CrossRef]
- Van Caenegem, E.; Wierckx, K.; Taes, Y.; Dedecker, D.; Van de Peer, F.; Toye, K.; Kaufman, J.M.; T’Sjoen, G. Bone mass, bone geometry, and body composition in female-to-male transsexual persons after long-term cross-sex hormonal therapy. J. Clin. Endocrinol. Metab. 2012, 97,
2503–2511 . [Google Scholar] [CrossRef] [PubMed] - Wierckx, K.; Mueller, S.; Weyers, S.; Van Caenegem, E.; Roef, G.; Heylens, G.; T’Sjoen, G. Long-term evaluation of cross-sex hormone treatment in transsexual persons. J. Sex. Med. 2012, 9,
2641–2651 . [Google Scholar] [CrossRef] - Wiepjes, C.M.; de Jongh, R.T.; de Blok, C.J.; Vlot, M.C.; Lips, P.; Twisk, J.W.; den Heijer, M. Bone safety during the first ten years of gender-affirming hormonal treatment in transwomen and transmen. J. Bone Miner. Res. 2018, 34, 447–454. [Google Scholar] [CrossRef]
- Broulik, P.D.; Urbánek, V.; Libanský, P. Eighteen-year effect of androgen therapy on bone mineral density in trans(gender) men. Horm. Metab. Res. 2018, 50, 133–137. [Google Scholar] [CrossRef]
- Langdahl, B.; Ferrari, S.; Dempster, D.W. Bone modeling and remodeling: Potential as therapeutic targets for the treatment of osteoporosis. Ther. Adv. Musculoskelet. Dis. 2016, 8, 225–235. [Google Scholar] [CrossRef] [PubMed]
- Chen, A.B.; Minami, K.; Raposo, J.F.; Matsuura, N.; Koizumi, M.; Yokota, H.; Ferreira, H.G. Transient modulation of calcium and parathyroid hormone stimulates bone formation. Endocrine2016, 54, 232–240. [Google Scholar] [CrossRef] [PubMed]
- Body, J.; Niepel, D.; Tonini, G. Hypercalcaemia and hypocalcaemia: Finding the balance. Support. Care Cancer 2017, 25, 1639–1649. [Google Scholar] [CrossRef] [PubMed]
- Okyay, E.; Ertugrul, C.; Acar, B.; Sisman, A.R.; Onvural, B.; Ozaksoy, D. Comparative evaluation of serum levels of main minerals and postmenopausal osteoporosis. Maturitas 2013, 76, 320–325. [Google Scholar] [CrossRef]
- Katsumata, S.; Matsuzaki, H.; Uehara, M.; Suzuki, K. Effects of dietary calcium supplementation on bone metabolism, kidney mineral concentrations, and kidney function in rats fed a high-phosphorus diet. J. Nutr. Sci. Vitaminol. 2015, 61, 195–200. [Google Scholar] [CrossRef] [PubMed]
- Szulc, P.; Bauer, D.C. Biochemical markers of bone turnover in osteoporosis. In Osteoporosis, 4th ed.; Marcus, R., Feldman, D., Dempster, D.W., Cauley, J., Feldman, D., Eds.; Academic Press: Cambridge, MA, USA, 2013; pp. 1573–1610. [Google Scholar]
- Garnero, P.; Delmas, P.D. Assessment of the serum levels of bone alkaline phosphatase with a new immunoradiometric assay in patients with metabolic bone disease. J. Clin. Endocrinol. Metab. 1993, 77, 1046–1053. [Google Scholar]
- Mizokami, A.; Kawakubo-Yasukochi, T.; Hirata, M. Osteocalcin and its endocrine functions. Biochem. Pharmacol. 2017, 132, 1–8. [Google Scholar] [CrossRef]
- Ensrud, K.E. Epidemiology of fracture risk with advancing age. J. Gerontol. Ser. A Biol. Sci. Med. Sci. 2013, 68, 1236–1242. [Google Scholar] [CrossRef]
- Moyer, V.A.; U.S. Preventive Services Task Force. Vitamin D and calcium supplementation to prevent fractures in adults: U.S. Preventive Services Task Force recommendation statement. Ann. Intern. Med. 2013, 158, 691–696. [Google Scholar]
- Fanghänel, J.; Gedrange, T.; Proff, P. Bone quality, quantity and metabolism in terms of dental implantation. Biomed. Eng. 2008, 53, 215–219. [Google Scholar] [CrossRef] [PubMed]
- Reid, I.R.; Ames, R.; Mason, B.; Reid, H.E.; Bacon, C.J.; Bolland, M.J.; Gamble, G.D.; Grey, A.; Horne, A. Randomized controlled trial of calcium supplementation in healthy, non-osteoporotic, older men. Arch. Intern. Med. 2008, 168,
2276–2282 . [Google Scholar] [CrossRef] [PubMed] - Riggs, B.L.; O’Fallon, W.M.; Muhs, J.; O’Connor, M.K.; Kumar, R.; Melton, L.J., III. Long-term effects of calcium supplementation on serum parathyroid hormone level, bone turnover, and bone loss in elderly women. J. Bone Miner. Res. 1998, 13, 168–174. [Google Scholar] [CrossRef] [PubMed]
- Vasikaran, S.; Cooper, C.; Eastell, R.; Griesmacher, A.; Morris, H.; Trenti, T.; Kanis, J. International Osteoporosis Foundation and International Federation of Clinical Chemistry and Laboratory Medicine position on bone marker standards in osteoporosis. Clin. Chem. Lab. Med. 2011, 49, 1271–1274. [Google Scholar] [CrossRef] [PubMed]
- Szulc, P. Bone turnover: Biology and assessment tools. Best Pract. Res. Clin. Endocrinol. Metab. 2018, 32, 725–738. [Google Scholar] [CrossRef]
- Basler, S.; Traxler, J.; Müller, R.; van Lenthe, G. Peri-implant bone microstructure determines dynamic implant cut-out. Med. Eng. Phys.2013, 35, 1442–1449. [Google Scholar] [CrossRef] [PubMed]
- Schiuma, D.; Brianza, S.; Tami, E. Development of a novel method for surgical implant design optimization through noninvasive assessment of local bone properties. Med. Eng. Phys. 2011, 33, 256–262. [Google Scholar] [CrossRef]
- Javed, F.; Ahmed, H.; Crespi, R.; Romanos, G. Role of primary stability for successful osseointegration of dental implants: Factors of influence and evaluation. Interv. Med. Appl. Sci.2013, 5, 162–167. [Google Scholar] [CrossRef]
- Wilson, T.G., Jr.; Miller, R.J.; Trushkowsky, R.; Dard, M. Tapered Implants in dentistry: Revitalizing Concepts with technology: A review. Adv. Dent. Res. 2016, 28, 4–9. [Google Scholar] [CrossRef]
- Stocchero, M.; Toia, M.; Cecchinato, D.; Becktor, J.; Coelho, P.; Jimbo, R. Biomechanical, biologic, and clinical outcomes of undersized implant surgical preparation: A systematic review. Int. J. Oral Maxillofac. Implant.2016, 31, 1247–1263. [Google Scholar] [CrossRef]
- Guobis, Z.; Pacauskiene, I.; Astramskaite, I. General diseases influence on peri-Implantitis development: A systematic review. J. Oral Maxillofac. Res. 2016, 7, e5. [Google Scholar] [CrossRef]
- Dereka, X.; Calciolari, E.; Donos, N.; Mardas, N. Osseointegration in osteoporotic-like condition: A systematic review of preclinical studies. J. Periodontal Res. 2018, 53, 933–940. [Google Scholar] [CrossRef]
- Radi, I.; Ibrahim, W.; Iskandar, S.; AbdelNabi, N. Prognosis of dental implants in patients with low bone density: A systematic review and meta-analysis. J. Prosthet. Dent.2018, 120, 668–677. [Google Scholar] [CrossRef]
- De Medeiros, F.; Kudo, G.; Leme, B.; Saraiva, P.; Verri, F.; Honório, H.; Pellizzer, E.; Santiago Junior, J. Dental implants in patients with osteoporosis: A systematic review with meta-analysis. Int. J. Oral Maxillofac. Surg. 2018, 47, 480–491. [Google Scholar] [CrossRef] [PubMed]
- Famili, P.; Zavoral, J. Low Skeletal Bone Mineral Density Does Not Affect Dental Implants. J. Oral Implantol.2015, 41, 550–553. [Google Scholar] [CrossRef]
- Marquezan, M.; Osório, A.; Sant’Anna, E.; Souza, M.; Maia, L. Does bone mineral density influence the primary stability of dental implants? A systematic review. Clin. Oral Implants. Res. 2012, 23, 767–774. [Google Scholar] [CrossRef] [PubMed]
- Unger, C. Hormone therapy for transgender patients. Transl. Androl. Urol. 2016, 5, 877–884. [Google Scholar] [CrossRef] [Green Version]
- He, J.; Zhao, B.; Deng, C.; Shang, D.; Zhang, C. Assessment of implant cumulative survival rates in sites with different bone density and related prognostic factors: An 8-year retrospective study of 2,684 implants. Int. J. Oral Maxillofac. Implants 2015, 30, 360–371. [Google Scholar] [CrossRef]
© 2019 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).